
【题目】下列关于电解池的叙述中不正确的是( )
A.与电源正极相连的是电解池的阳极
B.电子从电源的负极沿导线流入电解池的阴极
C.电解质溶液导电过程是物理变化
D.电解池和原电池中均发生氧化还原反应
科目:高中化学 来源: 题型:
【题目】由W、X、Y、Z四种金属按下列装置进行实验。下列说法不正确的是
装置 |
|
|
|
现象 | 金属W不断溶解 | Y的质量增加 | W上有气体产生 |
A. 装置甲中W作原电池负极
B. 装置乙中Y电极上的反应式为Cu2++2e=Cu
C. 装置丙中溶液的pH减小
D. 四种金属的活动性强弱顺序为Z>W>X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.碳棒可以用作原电池的负极
B.任何化学反应都能设计成原电池
C.原电池是将化学能转化为电能的装置
D.原电池中电流流向和电子流向相反
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中发生N2(g)+3H2(g)![]() 2NH3(g)△H<0,达到平衡后改变某一条件,下列说法正确的是( )
2NH3(g)△H<0,达到平衡后改变某一条件,下列说法正确的是( )
A. 升高温度,正反应速率减小,逆反应速率增大,平衡逆向移动
B. 升高温度可提高N2转化率
C. 增加H2的浓度,可提高N2转化率
D. 改用高效催化剂,可增大反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属的叙述中,正确的是( )
A.所有的金属都是固态的
B.金属具有导电性、导热性和延展性
C.历史上人类使用最早的金属是铁
D.金属元素在自然界中都是以化合态存在的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列可逆反应达到平衡后,增大压强同时升高温度,平衡一定向右移动的是( )
A. A(s)+B(g)![]() C(g)+D(g) ΔH>0
C(g)+D(g) ΔH>0
B. A2(g)+3B2(g)![]() 2AB3(g) ΔH<0
2AB3(g) ΔH<0
C. 2AB(g)![]() A2(s)+B2(g) ΔH>0
A2(s)+B2(g) ΔH>0
D. 2A(g)+B(g)![]() 3C(g)+D(s) ΔH<0
3C(g)+D(s) ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:mA (g) +nB (g)![]() pc (g) ,达到平衡后,当升高溫度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pc (g) ,达到平衡后,当升高溫度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为____热反应,且m+n____p (填“>”、 “=” 、“<”)。
(2)减压时,A的质量分数______.(填“增大”、“减小”或“不变”,下同)
(3)若加入B (体积不变),则A的转化率_____,B的转化率_________。
(4)若升高溫度,则平衡时B、C的浓度之比将__________。
(5)若加入催化剂,平衡时气体混合物的总物质的量______________。
(6)若B是有色物质,A、C均无色,则加入C (体积不变)时混合物颜色______,而维持容器内压强不变,充入氖气时,混合物颜色______(填“变深”、 “变浅”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铝在生产生活中有广泛用途。
(1)铝元素在元素周期表中位于______________。
(2)用化学方程式表示工业制备铝单质______________。 铝热反应可用于焊接钢轨,下图为铝热反应的实验装置图。
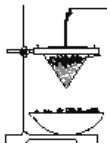
(3) 该铝热反应的化学方程式是______________。铝热反应的反应现象说明反应物的总能量___________生成物的总能量(填“<”、“>”或“=”)。
(4)铝热反应在工业上用于冶炼______________金属(填编号)。
A. 强还原性 B. 难熔性 C. 易导电 D. 活泼
(5)反应结束后,从沙中取出生成的固体物质,有同学推测该固体是铁铝合金,他设计了如下实验证明此 固体中含有金属铝:取少量固体于试管中,滴加______________,当观察到______________现象时,证明固体中含有金属铝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:

相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
回答下列问题:
(1)焙烧过程中主要反应的化学方程式为_______________________。
(2)滤渣1的主要成分除SiO2外还有___________;氧化除杂工序中ZnO的作用是____________,若不通入氧气,其后果是________________。
(3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为_________________。
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为______________;沉积锌后的电解液可返回_______工序继续使用。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com