
是一种高能燃料,有关化学反应的能量变化如题12所示,已知断裂1mol化学键所需的能量(kJ):N=N为942、O=O为500、N−N为154,则断裂1molN−H键所需的能量(KJ)是


A.194 B.391 C.516 D.658
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:
在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断正确的是( )
A.含等物质的量的AlO2-、OH-、CO32-的溶液中,逐滴加入盐酸:AlO2-、OH-、CO32-
B.含等物质的量的FeBr2、FeI2的溶液中 ,缓慢通入氯气:I-、Br-、Fe2+
,缓慢通入氯气:I-、Br-、Fe2+
C.含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2:KOH、Ba(OH) 2、K2CO3、BaCO3
2、K2CO3、BaCO3
D.含等物质的量的Fe3+、Cu2+、H+的溶液中加入锌粉:Fe3+、Cu2+、H+、Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2Cl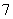 和AlCl
和AlCl 组成的离子液体作电解液时,可在钢制品上电镀铝。
组成的离子液体作电解液时,可在钢制品上电镀铝。
(1)钢制品接电源的________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为__________________________________________。若改用AlCl3水溶液作电解液,则阴极产物为________。
(2)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为________mol。
(3)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有________。
a.KCl b.KClO3 c.MnO2 d.Mg
取少量铝热反应所得的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,______________(填“能”或“ 不能”)说明固体混合物中无Fe2O3,理由是________(用离子方程式说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列反应的热化学方程式:
6C(s)+5H2(g)+3 N2(g)+9O2(g)=2C3H5(ONO2)3(l) △H1
N2(g)+9O2(g)=2C3H5(ONO2)3(l) △H1
2 H2(g)+ O2(g)= 2H2O(g) △H2
C(s)+ O2(g)=CO2(g) △H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
A.12△H3+5△H2-2△H1 B.2△H1-5△H2-12△H3
C.12△H3-5△H2 -2△H1 D.△H1-5△H2-12△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
NOx是汽车尾气中的主要污染物之一。
(1) NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:_ .
(2)汽车发动机工作时会引发N2和02反应,其能量变化示意图如下:
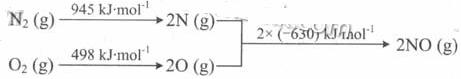
①写出该反应的热化学方程式: _ 。
②随温度升高,该反应化学平衡常数的变化趋势是_ 。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOX的排放。
①当尾气中空气不足时,NOX在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:_ 。
② 当尾气中空气过量时,催化转化器中的金属氧化物吸收NOX生成盐。其吸收能力顺序如下:12MgO <2oCaO <38SrO<56BaO。原因是 ,元素的金属性逐渐增强,金属氧化物对NOX的吸收能力逐渐增强。
通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
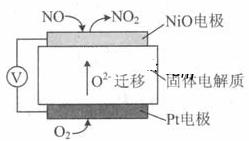
①Pt电极上发生的是 反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下密闭容器中用H2还原WO3可得到金属钨,其总反应为: WO3(s)+3H2(g) W (s) +3H2O (g)
W (s) +3H2O (g)
请回答下列问题:
⑴上述反应的化学平衡常数表达式为 。
⑵某温度下反应达到平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转 化率为 ;随着温度的升高,H2与水蒸气的体积比减小,则该反应为 反应(填“吸热”或“放热”)。
化率为 ;随着温度的升高,H2与水蒸气的体积比减小,则该反应为 反应(填“吸热”或“放热”)。
⑶上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25 ℃~550 ℃~600 ℃~700 ℃ |
| 主要成分 | WO3 W2O5 WO2 W |
第一阶段反应的化学方程式为 ;580 ℃时,固体物质的主要成分为 ;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为  。
。
⑷已知:温度过高时,WO2(s)转变为WO2(g):
WO2(s)+2H2(g)  W(s)+2H2O (g) ∆H=+66.0 kJ/mol
W(s)+2H2O (g) ∆H=+66.0 kJ/mol
WO2(g)+2H2(g)  W(s)+2H2O (g) ∆H=-137.9 kJ/mol
W(s)+2H2O (g) ∆H=-137.9 kJ/mol
则WO2(s)  WO2(g)的∆H= 。
WO2(g)的∆H= 。
⑸钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W(s)+ 2 I2 (g) 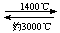 WI4 (g)。下列说法正确的有 。
WI4 (g)。下列说法正确的有 。
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应的△H=+100kJ·mol-1,下列有关该反应的叙述正确的是
A.正反应活化能小于100kJ·mol-1
B.逆反应活化能一定小于100kJ·mol-1
C.正反应活化能不小于100kJ·mol-1
D.正反应活化能比逆反应活化能大100kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下表列出了3种燃煤烟气脱硫方法的原理。
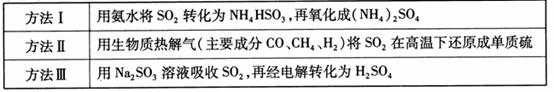
(1) 方法Ⅰ中氨水吸收燃煤烟气中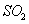 的化学反应为:
的化学反应为:
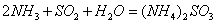
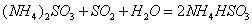
能提高燃煤烟气中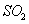 去除率的措施有 ▲ (填字母)。
去除率的措施有 ▲ (填字母)。
A.增大氨水浓度
B.升高反应温度
C.使燃煤烟气与氨水充分接触
D. 通入空气使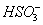 转化为
转化为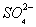
采用方法Ⅰ脱硫,并不需要预先除去燃煤烟气中大量的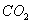 ,原因是▲(用离子方程式表示)。
,原因是▲(用离子方程式表示)。
(2) 方法Ⅱ重要发生了下列反应:
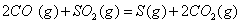

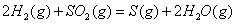
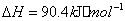
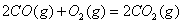
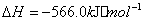
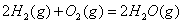

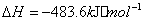
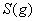 与
与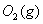 反应生成
反应生成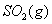 的热化学方程式为 。
的热化学方程式为 。
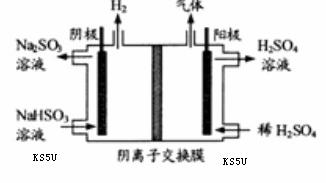
(3) 方法Ⅲ中用惰性电极电解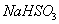 溶液的装置
溶液的装置
如右图所示。阳极区放出气体的成分为 。
(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于胶体的叙述不正确的是 ( )
A.胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9 ~ 10-7m之间
B.光线透过胶体时,胶体中可发生丁达尔效应
C.用平行光照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同
D.Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com