
NOx是汽车尾气中的主要污染物之一。
(1) NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:_ .
(2)汽车发动机工作时会引发N2和02反应,其能量变化示意图如下:
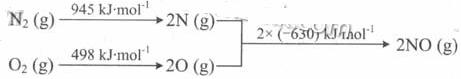
①写出该反应的热化学方程式: _ 。
②随温度升高,该反应化学平衡常数的变化趋势是_ 。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOX的排放。
①当尾气中空气不足时,NOX在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:_ 。
② 当尾气中空气过量时,催化转化器中的金属氧化物吸收NOX生成盐。其吸收能力顺序如下:12MgO <2oCaO <38SrO<56BaO。原因是 ,元素的金属性逐渐增强,金属氧化物对NOX的吸收能力逐渐增强。
通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
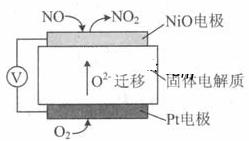
①Pt电极上发生的是 反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式: 。
科目:高中化学 来源: 题型:
下列各组离子能大量共存,向溶液中通入足量相应气体后,各离子还能大量存在的是( )
A.氯气:K+ Ba2+ SiO32- NO3-
B.二氧化硫:Na+ NH4+ SO32- C1-
C.氨气:K+ Na+ AlO2-. CO32-
D.甲醛:Ca2+ Mg2+ Mn04- NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其他电极均为Cu,则( )
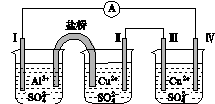
图4
A.电流方向:电极Ⅳ―→ ―→电极Ⅰ
―→电极Ⅰ
B.电极Ⅰ发生还原反应
C.电极Ⅱ逐渐溶解
D.电极Ⅲ的电极反应:Cu2++2e-===Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1)氢气是清洁燃料,其燃烧产物为________。
(2)NaBH4是一种重要的储氢载体,能与水反应得到NaBO2,且反应前后B的化合价不变,该反应的化学方程式为__________________________________________,反应消耗1 mol NaBH4时转移的电子数目为________。
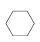 (3)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
(3)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
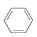 (g)
(g)  (g)+3H2(g)。
(g)+3H2(g)。
在某温度下,向恒容密闭容器中加入环己烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=________。
(4)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
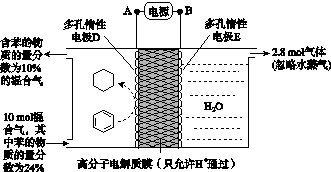
①导线中电子移动方向为________。(用A、D表示)
②生成目标产物的电极反应式为__________________。
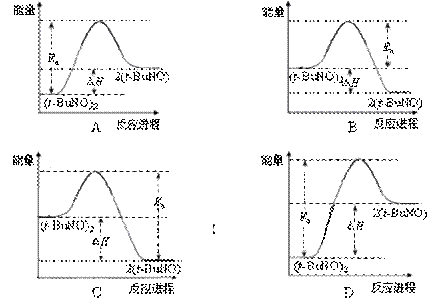
③该储氢装置的电流效率η=____________________。(η=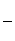 ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见
A. NH4HCO3和盐酸的反应是放热反应
B.该反应中,热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量
D.反应的热化学方程式为:NH4HCO3+HCl→NH4Cl+CO2↑+H2O-Q
查看答案和解析>>
科目:高中化学 来源: 题型:
是一种高能燃料,有关化学反应的能量变化如题12所示,已知断裂1mol化学键所需的能量(kJ):N=N为942、O=O为500、N−N为154,则断裂1molN−H键所需的能量(KJ)是


A.194 B.391 C.516 D.658
查看答案和解析>>
科目:高中化学 来源: 题型:
物质(t-BuNO)2在正庚烷溶剂中发生如下反应:(t-BuNO)2  2(t-BuNO) 。
2(t-BuNO) 。
(1)当(t-BuNO)2的起始浓度(c0)为0.50 mol·L-1时,实验测得20℃时的平衡转化率(α)是65 %。列式计算20℃时上述反应的平衡常数K = 。
(2)一定温度下,随着(t-BuNO)2的起始浓度增大,其平衡转化率 (填“增大”、“不变”或“减小”)。
已知20℃时该反应在CCl4溶剂中的平衡常数为1.9,若将反应溶剂正庚烷改成CCl4,并保持(t-BuNO)2起始浓度相同,则它在CCl4溶剂中的平衡转化率 (填“大于”、“等于”或“小于”)其在正庚烷溶剂中的平衡转化率。
(3)实验测得该反应的ΔH = 50.5 kJ·mol-1,活化能Ea = 90.4 kJ·mol-1。下列能量关系图合理的是 。
(4)该反应的ΔS 0(填“>”、“<”或“=”)。在 (填“较高”或“较低”)温度下有利于该反应自发进行。
(5)随着该反应的进行,溶液的颜色不断变化,分析溶液颜色与反应物(或生成物)浓度的关系(即比色分析),可以确定该化学反应的速率。用于比色分析的仪器 是 。
A.pH计 B.元素分析仪
C.分光光度计 D.原子吸收光谱仪
(6)通过比色分析得到30℃时(t-BuNO)2浓度随时间的变化关系如下图所示,请在同一图中绘出t-BuNO浓度随时间的变化曲线。
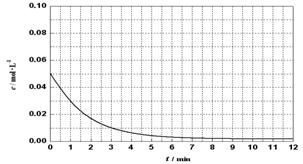
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
(1)Y位于元素周期表第 周期表 族,Y和Z的最高价氧化物对应的水化物的酸性较强的是 (写化学式)。
(2)XY2是一种常用的溶剂,XY2的分子中存在 个σ键。在H―Y、H―Z两种共价键中,键的极性较强的是 ,键长较长的是 。
(3)W的基态原子核外电子排布式是 。W2Y在空气中煅烧生成W2O的化学方程式是 。
(4)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y。
已知:XO(g)+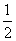 O2(g)=XO2(g)
O2(g)=XO2(g)  H=-283.0 kJ·mol-2
H=-283.0 kJ·mol-2
Y(g)+ O2(g)=YO2(g)  H=-296.0 kJ·mol-1
H=-296.0 kJ·mol-1
此反应的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的分类正确的是 ( )
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | Na2CO3 | H2SO4 | NaOH | SO2 | CO2 |
| B | NaOH | HCl | NaCl | Na2O | CO |
| C | NaOH | CH3COOH | CaF2 | CO | SO2 |
| D | KOH | HNO3 | CaCO3 | CaO | SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com