
【题目】在下列化合物中:H2O、Na2O、I2、NaCl、KOH、CO2、NH4Cl、Na2O2,请填空:
(1)含有极性共价键的离子化合物有___________。
(2)请写出Na2O2的电子式__________。
科目:高中化学 来源: 题型:
【题目】铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如右图。若上端开口关闭,可得到强还原性的H·(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的·OH(羟基自由基)。下列说法正确的是

A. 无论是否鼓入空气,负极的电极反应式均为Fe-3e-= Fe3+
B. 鼓入空气时,每生成1mol·OH有2mol电子发生转移
C. 不鼓入空气时,正极的电极反应式为H+ + e- = H·
D. 处理含有C2O42-的污水时,上端开口应关闭
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,反应后固体质量减轻的是( )
①氨气通过灼热的CuO粉末
②二氧化碳通过Na2O2粉末
③水蒸气通过灼热的Fe粉
④Zn投入CuSO4溶液.
A. ①② B. ①④ C. ②③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是草酸溶液中H2C2O4、HC2O4-、C2O42-三种微粒的分布分数(某微粒物质的量浓度与三种微粒物质的量浓度和的比值)与pH的关系,下列有关说法不正确的是

A. pH=5 的溶液中c(C2O42-)>c(HC2O4-)
B. NaHC2O4溶液中:c(OH-)+c(C2O42-)=c(H+)+c(H2C2O4)
C. 向NaHC2O4溶液中加强酸至pH与a点对应时,溶液中 2c(Na+)=c(HC2O4-)+ c(H2C2O4)
D. 为使溶液中c(c(HC2O4-)尽可能多一些,溶液的pH最好控制在2.7左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应N2(g)+3H2(g)![]() 2NH3(g) △H<0,达到平衡后,当单独改变下列条件后,有关叙述错误的是( )
2NH3(g) △H<0,达到平衡后,当单独改变下列条件后,有关叙述错误的是( )
A. 加催化剂,v正、v逆都发生变化且变化的倍数相等
B. 加压,v正、v逆都增大,且v正增大倍数大于v逆增大倍数
C. 降温,v正、v逆都减小,且v正减小倍数小于v逆减小倍数
D. 加入氩气,v正、v逆都增大,且v正增大倍数大于v逆增大倍数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一些常见有机物的转化如图下列说法正确的是( )

A. 上述有机物中只有C6H12O6属于糖类物质 B. 物质A和B都属于电解质
C. 物质C和油脂类物质互为同系物 D. 转化1可在人体内完成,该催化剂属于蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电讯器材元件材料MnCO3在空气中加热易转化为不同价态锰的氧化物,其固体残留率随温度变化如下图。下列说法不正确的是( )
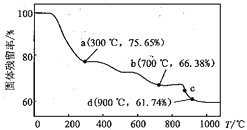
A. a 点剩余固体中n(Mn) : n(O) = 1 : 2
B. b 点对应固体的成分为Mn3O4
C. c 点发生的反应为2MnO2 △ 2MnO+O2↑
D. d 点对应固体的成分为MnO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究Na 与CO2反应产物,某化学兴趣小组按下图装置进行实验。
已知:CO + 2Ag ( NH3) 2OH=2Ag↓+( NH4 ) 2CO3 +2NH3

回答下列问题:
(1)写出A 中反应的离子方程式__________________________。
(2)仪器X 的名称是_____________,B 中的溶液为________________。
(3)先称量硬质玻璃管的质量为m1 g ,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2 g 。再进行下列实验操作,其正确顺序是________(填标号);
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,通入CO2至E 中出现浑浊
e.称量硬质玻璃管 f.冷却到室温
重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3 g 。
(4)加热硬质玻璃管一段时间,观察到以下现象
① 钠块表面变黑,熔融成金属小球;
② 继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;③ F 中试管内壁有银白物质产生。
产生上述②现象的原因是____________________________________。
(5)探究固体产物中元素Na 的存在形式
假设一:只有Na2CO3;假设二:只有Na2O ;假设三:Na2O和Na2CO3均有
完成下列实验设计,验证上述假设:
步骤 | 操作 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤 | 假设一成立 |
2 | 往步骤1所得滤液中___________________________ | |
3 | _____________________________________________ |
(6)根据上述实验现象及下表实验数据,写出Na 与CO2反应的总化学方程式___________。
m1 | m2 | m3 |
66.7g | 69.0g | 72.1g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com