
|
(16分)粉煤灰,是从煤燃烧后的烟气中收捕下来的细灰,粉煤灰是燃煤电厂排出的主要固体废物。我国火电厂粉煤灰的主要氧化物为:SiO2、Al2O3,还含有FeO、Fe2O3等。现将提取粉煤灰中Al、Si等元素,某科研小组的同学设计了如下工艺流程:  请回答下列问题: (1)操作i所需要的玻璃仪器有: (填序号)。 a.铁架台 b.烧杯 c.冷凝管 d.玻璃棒 e.集气瓶 f.分液漏斗 g.漏斗 (2)写出粉煤灰与过量NaOH溶液反应的离子方程式 。 (3)写出向固体A中加入过量稀H2SO4和过量H2O2时发生的离子反应方程式 。 (4)写出生成固体H的离子方程式 。 (5)该科研小组的同学准备用0.1 mol·L-1KSCN溶液和0.5000mol·L-1KI溶液滴定溶液B,以测定粉煤灰中Fe元素的含量: ①为减小实验误差,由固体A制备溶液B过程中煮沸的目的是 (请用化学方程式表示)。 ②判断滴定终点的现象为 。 ③将溶液B配制成250mL溶液后,取出25.00mL装入锥形瓶中,再滴入1~2滴KSCN溶液进行滴定,滴定过程中使用KI溶液的量如下表所示:
④若滴定操作太慢,则滴定结果 (填“偏小”、“偏大”或“无影响”);原因是 (请用离子方程式及简单的文字描述)。 |
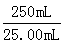 ×0.5000×30.00×10-3mol m(Fe3+)
×0.5000×30.00×10-3mol m(Fe3+)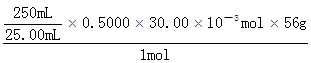 =8.40g
=8.40g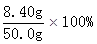 =16.8%。
=16.8%。

科目:高中化学 来源:不详 题型:单选题
| A.Al2(SO4)3溶液滴加氨水产生白色胶状沉淀: Al3++3OH-= Al(OH)3↓ |
B.90 ℃时,测得纯水中c(H+)·c(OH-) =3.8×10—13: H2O(l) H+(aq)+OH-(aq)?H<0 H+(aq)+OH-(aq)?H<0 |
| C.FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2 +2H2O = 2Fe2++SO42-+ 4H+ |
D.碳酸钠溶液滴入酚酞变红:CO32-+ 2H2O  H2CO3+2OH- H2CO3+2OH- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝:4H++4I-+O2=2I2+2H2O |
B.向K2Cr2O7溶液中滴加少量浓硫酸,溶液变为黄色: Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+ 2CrO42-(黄色)+2H+ |
| C.0.01 mol·L-1NH4Al(SO4)2溶液与0.02 mol·L-1Ba(OH )2溶液等体积混合有白色沉淀生成: Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O |
D.用铜电极电解饱和食盐水:2Cl-+2H2O Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
B.硫化钠的水解反应:S2-+H3O+ HS-+H2O HS-+H2O |
| C.1 mol/L的KAl(SO4) 2溶液与2 mol/L的Ba(OH) 2溶液等体积混合:Al3++4OH—= AlO2—+2H2O |
| D.用食醋溶解水垢:2H++CaCO3=Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.水玻璃长时间放置在空气中:SiO32-+CO2+H2O=H2SiO3↓+HCO3- |
| B.硫酸铜溶液显酸性:Cu2++2H2O=Cu(OH)2↓+2H+ |
C.用石墨电极电解饱和食盐水:2H++2Cl-  H2↑+Cl2↑ H2↑+Cl2↑ |
| D.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na2O2是离子化合物,其阴、阳离子个数比为1∶1 |
B.N(NO2)3( )既有氧化性又有还原性 )既有氧化性又有还原性 |
C.NH4HCO3溶液与过量的NaOH溶液微热反应:NH4++OH- NH3↑+H2O NH3↑+H2O |
| D.铜片溶于稀硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.氯气通入水中:Cl2 + H2O  2H+ + Cl-+ClO- 2H+ + Cl-+ClO- |
| B.氢氧化铁胶体中加入HI溶液:Fe(OH)3 + 3H+ = Fe3+ + 3H2O |
| C.NaAlO2溶液中通入过量CO2:2AlO2-+ CO2 + 3H2O = 2Al(OH)3↓+ CO32- |
| D.用稀硝酸除去试管内壁银:3Ag+ 4H+ + NO3- = 3Ag+ + NO↑ +2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl- |
| B.x=0.6a,2Br-+Cl2=Br2+2Cl- |
| C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl- |
| D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2++2Fe3++6Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碳酸氢钠溶液中滴入氢氧化钙溶液:HCO3-+OH-=CO32-+H2O |
| B.二氧化硫通入次氯酸钠溶液:SO2+ClO-+2OH-=SO42-+Cl-+H2O |
| C.硫化钡加入稀硫酸:BaS+2H+=H2S↑+Ba2+ |
| D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com