
A.氯气通入水中:Cl2 + H2O  2H+ + Cl-+ClO- 2H+ + Cl-+ClO- |
| B.氢氧化铁胶体中加入HI溶液:Fe(OH)3 + 3H+ = Fe3+ + 3H2O |
| C.NaAlO2溶液中通入过量CO2:2AlO2-+ CO2 + 3H2O = 2Al(OH)3↓+ CO32- |
| D.用稀硝酸除去试管内壁银:3Ag+ 4H+ + NO3- = 3Ag+ + NO↑ +2H2O |
科目:高中化学 来源:不详 题型:问答题






| 滴定次数 | 待测溶液 的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X可能是周期表中第二周期元素 |
| B.X元素的原子最外层上有7个电子 |
| C.X2是还原产物,H2O是氧化产物 |
| D.若生成3 mol X2,转移6 mol电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
|
(16分)粉煤灰,是从煤燃烧后的烟气中收捕下来的细灰,粉煤灰是燃煤电厂排出的主要固体废物。我国火电厂粉煤灰的主要氧化物为:SiO2、Al2O3,还含有FeO、Fe2O3等。现将提取粉煤灰中Al、Si等元素,某科研小组的同学设计了如下工艺流程:  请回答下列问题: (1)操作i所需要的玻璃仪器有: (填序号)。 a.铁架台 b.烧杯 c.冷凝管 d.玻璃棒 e.集气瓶 f.分液漏斗 g.漏斗 (2)写出粉煤灰与过量NaOH溶液反应的离子方程式 。 (3)写出向固体A中加入过量稀H2SO4和过量H2O2时发生的离子反应方程式 。 (4)写出生成固体H的离子方程式 。 (5)该科研小组的同学准备用0.1 mol·L-1KSCN溶液和0.5000mol·L-1KI溶液滴定溶液B,以测定粉煤灰中Fe元素的含量: ①为减小实验误差,由固体A制备溶液B过程中煮沸的目的是 (请用化学方程式表示)。 ②判断滴定终点的现象为 。 ③将溶液B配制成250mL溶液后,取出25.00mL装入锥形瓶中,再滴入1~2滴KSCN溶液进行滴定,滴定过程中使用KI溶液的量如下表所示:
④若滴定操作太慢,则滴定结果 (填“偏小”、“偏大”或“无影响”);原因是 (请用离子方程式及简单的文字描述)。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氢氧化镁与稀盐酸反应:H++OH-=H2O |
| B.向AlCl3溶液中加入少量氨水:Al3++3OH-=Al(OH)3↓ |
| C.铜溶于稀硝酸:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |
| D.向次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+ |
| B.NO2与水的反应:3NO2+H2O=NO3-+NO+2H+ |
| C.醋酸溶液水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.HCO3-水解的离子方程式:HCO3-+H2O CO32-+H3O+ CO32-+H3O+ |
B.碘水中通入适量的SO2:I2+SO2+2H2O===2I-+SO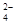 +4H+ +4H+ |
| C.过量的SO2通入NaOH溶液中:SO2—+2OH—=SO32—+H2O |
D.硝酸银溶液中滴加过量氨水:Ag++NH3·H2O===AgOH↓+NH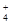 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验 | 现象 | 离子方程式 |
| A | 将稀硫酸滴加到KI淀粉溶液中 | 在空气中放置一段时间后溶液呈蓝色 | 4H++4I-+O2=2I2+2H2O |
| B | 用硫氰化钾溶液检验某溶液中含有Fe3+ | 溶液变成红色 | Fe3++3SCN-= Fe(SCN)3 |
| C | 酸性KMnO4溶液中加入Na2SO3溶液 | 溶液紫色褪去 | 2MnO4-+5SO32-+6H+ =2Mn2++5SO42-+3H2O |
| D | 将稀硫酸滴加到含有酚酞的Ba(OH)2溶液中 | 有白色沉淀生成,溶液由红色变成无色 | Ba2++OH-+H++SO42- =BaSO4↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com