
分析 (1)根据硝酸反应生成硝酸盐及硝酸中N元素的化合价变化来分析;
(2)利用电子守恒来计算作氧化剂的硝酸的物质的量,作酸性和作氧化剂的物质的量之和为参加反应的硝酸的物质的量,再根据NO不溶于水,3NO2+H2O═2HNO3+NO;
解答 解:(1)在该反应中硝酸反应生成硝酸盐,且硝酸中N元素的化合价降低,则作氧化剂,硝酸在反应中被还原,则对应的产物NO、NO2为还原产物,
故答案为:氧化性、酸性;
(2)设NO的物质的量为n,得到的NO和NO2物质的量相同,
由电子守恒可知,0.3mol×2=n×(5-2)+n×(5-4),
解得n=0.15mol,
则N原子守恒可知作氧化剂的硝酸为0.15mol+0.15mol=0.3mol,
由Cu(NO3)2可知,作酸性的硝酸为0.3mol×2=0.6mol,
则参加反应的硝酸的物质的量是0.3mol+0.6mol=0.9mol,
由3NO2+H2O═2HNO3+NO可知,0.15molNO2与水反应生成0.05molNO,
则用排水法收集这些气体,最后气体为NO,其物质的量为0.15mol+0.05mol=0.2mol,
在标准状况下,气体的体积为0.2mol×22.4L/mol=4.48L,
故答案为:0.9;4.48.
点评 本题考查氧化还原反应,明确反应中元素的化合价变化来分析氧化还原反应是关键,并利用电子守恒、质量守恒定律等来进行相关计算即可解答,


科目:高中化学 来源: 题型:选择题
| A. | Na与Na+ | B. | ${\;}_{20}^{40}$Ca与${\;}_{18}^{40}$Ar | ||
| C. | H与T | D. | O2与O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2既能与HF反应,又能与NaOH反应,属于两性氧化物 | |
| B. | 玛瑙和红宝石的主要成分都是SiO2,是制备半导体的材料 | |
| C. | 高温下SiO2能与Na2CO3反应放出CO2,说明硅酸酸性强于碳酸 | |
| D. | Na2SiO3溶液中逐滴加入盐酸可制备硅酸胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al的还原性依次减弱 | B. | I、Br、Cl的非金属性性依次增强 | ||
| C. | C、N、O 的原子半径依次增大 | D. | P、S、Cl的最高正化合价依次升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L H2O含有的分子数是NA | |
| B. | 常温常压下,NA个CO2占有的体积为22.4L | |
| C. | 1.06克Na2CO3含有Na+数为0.02NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.3mol/L | D. | 0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
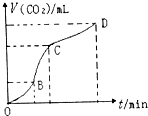 如图是用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体所绘制的图.请你根据图形判断,下列有关说法错误的是( )
如图是用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体所绘制的图.请你根据图形判断,下列有关说法错误的是( )| A. | CD段二氧化碳气体的体积小于BC段二氧化碳气体的体积 | |
| B. | 在OB、BC、CD三段中,BC段的反应速率最快,原因是该反应放热,温度在BC段起主要作用 | |
| C. | 相同条件下,向上述反应的溶液中加入NaCl溶液可降低化学反应的速率 | |
| D. | OB段反应物浓度大,所以OB段反应速率最快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com