
【题目】某同学设计了种用电解法制取Fe(OH)2的实验装置如图。通电后,溶液中产生白色沉淀,且较长时间不变色。下列说法中正确的是

A. 电源中"a"为正极," b"为负极
B. 电解池中的电解液可以是NaOH溶液但不能是NaCl溶液
C. A、B两端都必须使用铁作电极
D. B电极发生的反应:2H2O+2e-=H2↑+2OH-
【答案】A
【解析】电解法制备Fe(OH)2 时,采用金属Fe作阳极,阳极方程式为:Fe-2e-=Fe2+;阴极材料可以是铁也可以是其他材料,阴极方程式为:2H++2e-=H2↑,因为氢离子放电破坏水的电离平衡,使氢氧根离子浓度增大,与亚铁离子结合成Fe(OH)2沉淀。A、因为生成的氢气将装置中原有氧气带出,所以氢气从B端阴极析出,A电极则是铁做阳极失去电子生成亚铁离子,故A正确;B、电解池中阳极是铁失去电子发生氧化反应生成亚铁离子,阴极是溶液中的氢离子得电子发生还原反应,所以电解质溶液中的阴离子不会再阳极失电子,所以选用NaCl溶液不影响实验,故B错误;C、阳极应该用铁电极,阴极可以是铁也可以是其他惰性电极,故C错误;D、A电极发生的反应为阳极铁失电子的电极反应:Fe-2e-=Fe2+;故D错误;故选A。


科目:高中化学 来源: 题型:
【题目】下列关于苯的说法中,不正确的是( )
A. 苯不溶于水,可以作为萃取剂将溴从水中分离出来
B. 苯有毒,故不能作为有机溶剂
C. 苯是煤加工的产品之一
D. 苯是一种重要的化工原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质中:A.KI(s) B.C2H5OH(l) C.Cl2(g) D.CH3COOH(l) E.BaSO4(s) F.NaHSO4(s) G.石墨(s) H.蔗糖(s) I.NaOH(l)
属于非电解质的是_________,属于强电解质的是_________,能直接导电的是____________________,能溶于水,且水溶液能导电的是________________。
(2)将6g CH3COOH溶于水制成1L溶液,此溶液的物质的量浓度为________,经测定溶液中含CH3COO-为1.4×10-3mol/L,此温度下醋酸的电离常数:Ka=____________,温度升高Ka将____________(填“变大”、“不变”或“变小”)。
(3)Al(OH)3的电离方程式可表示为:H++AlO![]() +H2O
+H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH-。试根据平衡移动原理,解释下列有关的问题。
Al3++3OH-。试根据平衡移动原理,解释下列有关的问题。
a、向Al(OH)3沉淀中加入盐酸,沉淀溶解,其原因是_______________________,有关的离子方程式为________________________________。
b、向Al(OH)3沉淀中加入苛性钠溶液,沉淀溶解,其原因是_____________________,有关的离子方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2回收资源化利用是环保领域研宄的热点课题,
(1)在FeO催化下,以CO2为原料制取炭黑(C)的太阳能工艺如图1所示。
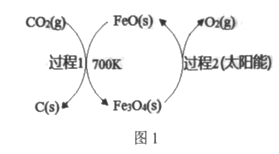
己知:①过程1生成lmolC(s)的反应热为△H1。
②过程2反应:Fe3O4(s)![]() 3FeO(s)+l/2O2(g) △H2。
3FeO(s)+l/2O2(g) △H2。
上述以CO2为原料制取炭黑总反应的热化学方程式为____________,若该反应的△S<0,请判断
该反应是否为自发反应并说明理由___________________。
(2)以CO2为原料可以催化加氢合成低碳烯烃,利用CO2合成乙烯的反应方程式为:2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g) △H3。在常压下,以 FeCoMnK/BeO 作催化剂,按n(CO2): n(H2)=l:3(总物质的量为4amol)的投料比充入密闭容器中发生反应。测得温度对CO2的平衡转化率和催化剂催化效率影响情况如图2所示。
C2H4(g)+4H2O(g) △H3。在常压下,以 FeCoMnK/BeO 作催化剂,按n(CO2): n(H2)=l:3(总物质的量为4amol)的投料比充入密闭容器中发生反应。测得温度对CO2的平衡转化率和催化剂催化效率影响情况如图2所示。

①下列说法不正确的是______________。
A. △H3<0;平衡常数:KM >KN
B.增加原催化剂的表面积,对平衡转化率无影响
C.生成乙烯的速率:v(M)有可能小于v(N)
D.若投料比改为n(CO2):n(H2)=1:2,可以提高CO2的平衡转化率
E.若投料比不变,温度越低,反应一定时间后CO2的转化率越高
②250℃下,上述反应达平衡时容器体积为VL,则此温度下该反应的平衡常数为___________(用含a、V的代数式表示)。
③某温度下,n(C2H4)随时间(t)的变化趋势曲线如图3所示。其它条件相同时,若容器的体积为其一半,画出0~t1时刻n(C2H4)随时间(t)的变化趋势曲线。______
(3)以稀硫酸为电解质溶液,利用太阳能可将CO2电解转化为低碳烯烃,则电解生成丙烯时,阴极的电极反应为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:2NO2(g)![]() N2O4(g) ΔH1
N2O4(g) ΔH1
2NO2(g) ![]() N2O4(l) ΔH2
N2O4(l) ΔH2
下列能量变化示意图中,正确的是 (填字母)。


(2)下图所示是某温度下,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为
。反应中如果加入1 mol氮气和3 mol氢气,反应放出的能量 (填“大于”“等于”或“小于”)92 kJ,原因是 。

(3)室温下,1 g苯(C6H6)完全燃烧生成液态水和CO2,放出41.8 kJ的热量。写出C6H6燃烧的热化学方程式: 。
(4)已知:H2(g)+Cl2(g)===2HCl(g) ΔH=185 kJ·mol1,断裂1 mol H—H键吸收的能量为436 kJ,断裂1 mol Cl—Cl键吸收的能量为247 kJ,则形成1 mol H—Cl键放出的能量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示装置中,两玻璃管及烧杯中是滴有酚酞的NaCl饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。

①接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中均有气体生成。则电极C(Ⅰ)是_____极(填“阳”或“阴”);C(Ⅱ)电极反应所得气体产物为_____________。
②通电一段时间后(玻璃管中液面未脱离电极), 断开S1,接通S2,电流表的指针发生偏转,此时电极C(Ⅰ)为____(填“正”或“负”)极;C(Ⅰ)的电极反应为______。
(2)若用此装置精炼粗铜,断开S2接通S1电解液选用CuSO4溶液;粗铜接电池的_______(填“正”或“负”)极,阴极发生的电极反应为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用下列图Ⅰ装置进行铜跟浓硫酸反应等一系列实验。
请回答:

(1)图I装置中的收集装置B应连接图Ⅱ中的__________(填“a”或“b”)进口。
(2)用此装置制SO2与将铜片直接加入试管A加热反应相比,其优点主要是______________。
(3)下列叙述中,描述正确的是______________。
A.A试管中发生了Cu与浓硫酸的反应,其中浓硫酸只体现了强氧化性
B.熄灭酒精灯后,因为A试管中的玻璃导管存在,整套装置不易发生倒吸
C.C试管中的紫色石蕊试液会变红,是因为二氧化硫溶于水后生成了 H2SO3
D.D、E试管中品红和高锰酸钾溶液都会褪色,其褪色原理相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com