
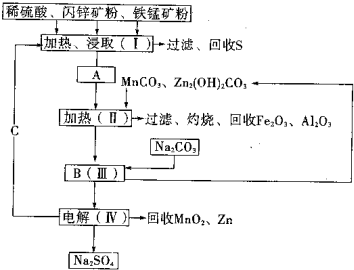
 某工厂用软锰矿(含MnO2约70%及少量Al2O3)和闪锌矿(古ZnS约80%及少量FeS)共同生产MnO2和Zn(干电池原料)生产工艺如下:
某工厂用软锰矿(含MnO2约70%及少量Al2O3)和闪锌矿(古ZnS约80%及少量FeS)共同生产MnO2和Zn(干电池原料)生产工艺如下: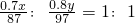 ,故x:y=1.03,故答案为:1.03.
,故x:y=1.03,故答案为:1.03.

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
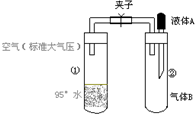 如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了.则液体A和气体B的组合不可能是下列的
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了.则液体A和气体B的组合不可能是下列的查看答案和解析>>
科目:高中化学 来源: 题型:解答题
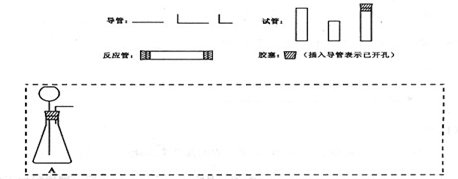
| 仪器符号 | 仪器中所加物质 | 作用 |
| A | 石灰石、稀盐酸 | 石灰石与盐酸生成CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com