
(1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是
(2)除去KNO3溶液中的I2杂质,主要操作步骤是:加CCl4后,振荡,静置, 。水溶液最终从分液漏斗的 分离出来
(3)黑火药是中国的“四大发明”之一。黑火药在发生爆炸时,发生如下的反应:
2KNO3+C+S=K2S+2NO2↑+CO2↑。其中被氧化的元素是 ,氧化剂是 ,生成1molCO2时转移的电子数目为(NA表示阿伏伽德罗常数的值)
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
铜是生物必需的微量元素,也是人类最早使用的金属之一。铜的生产和使用对国计民生各个方面都产生了深远的影响。
(1)写出铜与稀硝酸反应的化学方程式____________________________________________________。
(2)为了保护环境和节约资源,通常先用H2O2和稀硫酸的混合溶液溶出废旧印刷电路板中的铜,最终实现铜的回收利用。写出溶出铜的离子方程式__________________________________________________。
(3)工业上以黄铜矿为原料,采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+ Cu2S 6Cu+SO2,该反应的氧化剂是___________________;当生成19.2gCu时,反应中转移的电子为____________mol。
6Cu+SO2,该反应的氧化剂是___________________;当生成19.2gCu时,反应中转移的电子为____________mol。
(4)铜在潮湿的空气中能发生吸氧腐蚀而生锈,铜诱的主要成分为Cu2(OH)2CO3(碱式碳酸铜)。试写出上述过程中负极的电极反应式__________________________。
(5)研究性学习小组用“间接碘量法”测定某试样中CuSO4·5H2O(不含能与I-反应的氧化性杂质)的含量。取ag试样配成100mL溶液,每次取25.00mL,滴加KI溶液后有白色碘化物沉淀生成。写出该反应的离子方程式________________________________________。继续滴加KI溶液至沉淀不再产生,溶液中的I2用硫代硫酸钠标准溶液滴定,发生反应的化学方程式为:I2+2Na2S2O3=2NaI+Na2S4O6,平均消耗cmol/L的Na2S2O3溶液VmL。则试样中CuSO4·5H2O的质量分数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
阅读下列材料后回答问题。
一个体重60 kg健康的成年人,体内约含有4 g铁,这4 g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+转化为Fe2+,有利于人体吸收。
(1)在人体中进行Fe2+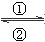 Fe3+的转化时, ①中的Fe2+作________剂,②中的Fe3+作___________剂。
Fe3+的转化时, ①中的Fe2+作________剂,②中的Fe3+作___________剂。
(2)“服用维生素C,可使食物中的Fe3+转化为Fe2+”这句话指出,维生素C在这一反应中作___________剂,具有___________性。
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的离子方程式为_______________
(并用单线桥法标出该式中的电子转移方向和数目)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
汽车尾气产生的NO2、CO等大气污染物,可以在催化剂的作用下转化为无毒物。其反应式可表示为:2NO2 +4CO=N2 +4CO2
①用双线法标出上述反应电子转移的方向和数目:
②该反应中氧化剂是 ,还原剂是 ,每有28g N2生成,反应中转移的电子为_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
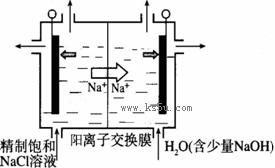
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是_______(填序号)。
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
锆(Zr)是一种重要的稀有元素。
(1)由锆英石(ZrSiO4)可制取ZrOC12-8H2O
①用碳熔炼锆英石制碳化锆的化学方程式为:ZrSiO4+3C ZrC+SiO2+2CO↑,该反应中氧化剂与还原剂的质量比为 。
ZrC+SiO2+2CO↑,该反应中氧化剂与还原剂的质量比为 。
②用烧碱熔ZrC制取Na2ZrO3,完成该反应的化学方程式:
□ZrC+□NaOH+□ 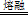 □Na2ZrO3+□CO2+□H2O
□Na2ZrO3+□CO2+□H2O
③碱熔料用盐酸浸出可得ZrOC12溶液。通过蒸发结晶从该溶液中获得ZrOC12-8H2O,还需用浓盐酸控制酸度,原因是 。
(2)ZrOC12-8H2O具有多方面的用途。用ZrOC12-8H2O和YC13制备Y2O3--ZrO2复合粉体的流程如下:
①共沉淀时,生成Zr(OH)4的化学方程式为 。
②当共沉淀恰好完全时,溶液中c(Zr4+)= 。
(已知Ksp[Zr(OH)4]=6.4×10—49,Ksp[Y(OH)3]=8.0×10—23;溶液中离子浓度为1×10-5mol?L-1时,可认为沉淀完全)
③将制得的一种复合粉体溶于水后,测得其微粒的平均直径为30 nm,该分散系属于 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
仔细阅读下列三段文字
①由稀有气体元素Xe(氙)与氧元素形成的一种共价化合物XeO3极不稳定,易转化为单质而呈强氧化性。将适量的XeO3投入含Mn2+的水溶液中,溶液逐渐变为紫红色且pH不断减小。
②将0.08 mol KMnO4固体(质量为12.64 g)加热一段时间后,收集到a mol O2;向反应后残留的固体中加入足量的浓盐酸,又收集到b mol Cl2,此时Mn元素全部以Mn2+的形式存在于溶液中。
③氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:Cl2+2e- =2Cl- 。
回答问题:
(1)试写出①有关的离子方程式:________________________________________________。
(2)请配平②的化学方程式:
____KMnO4+____HCl -______KCl+ _____MnCl2+_____Cl2↑+____ H2O
通过对第②段文字中提供的数据进行计算可得出:a +b的最大值为 ____ ,a +b最小值为_____。
(3)下列四种物质中能使③中的还原过程发生的物质是________。
| A.Na2CO3 | B.KMnO4 | C.XeO3 | D.Na2SO3 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知Ca3(PO4)2与SiO2、C高温共热可以反应得到CaSiO3、P4蒸气和CO。完成下列填空:
(1)该反应中氧化剂是_________,氧化产物是_________。
(2)写出该反应的化学方程式____________________________________________。
(3)每消耗24.0g碳时,有 mol电子发生转移,生成P4_______g。
(4)反应所得混合气体,折算成标况下,其气体密度为 g/L。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
硫代硫酸钠(Na2S2O3)可看成是一个S原子取代了Na2SO4中的一个O原子而形成。某校化学研究性学习小组运用类比学习的思想,通过实验探究Na2S2O3的化学性质。请填写以下空白:
【提出问题】Na2S2O3是否与Na2SO4相似具备下列性质呢?
猜想①:________________________。 猜想②:溶液呈中性,且不与酸反应。
猜想③:无还原性,不能被氧化剂氧化。
【实验探究】基于上述猜想②、③,设计实验方案。请填写下列表格中的(1)(2)(3)。
| | 实验操作 | 实验现象 或预期实验现象 | 现象解释 (用离子方程式表示) |
| 猜想② | | 溶液pH约8—10 | |
| 向pH=2的硫酸中滴加Na2S2O3溶液 | | S2O32—+2H+=S↓+SO2↑+H2O | |
| 猜想③ | 向新制氯水(pH<2)中滴加少量Na2S2O3溶液 | 氯水颜色变浅 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com