
【题目】从海带中提取碘,可经过以下实验步骤完成。下列有关说法正确的是( )
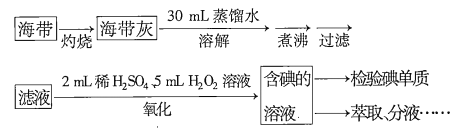
A.灼烧过程中使用的玻璃仪器有酒精灯、烧杯、玻璃棒
B.氧化过程中发生反应的离子方程式为![]()
C.检验碘单质时,可选用淀粉,若淀粉变蓝说明海带中一定含有碘单质
D.分液时,先打开活塞放出下层液体,再关闭活塞,从上口倒出上层液体
科目:高中化学 来源: 题型:
【题目】在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,下列分析中不正确的是( )
CO2(g)+H2(g) ΔH<0,下列分析中不正确的是( )

A. 图Ⅰ研究的是t0时升高温度对反应速率的影响
B. 图Ⅱ研究的是t0时增大压强(缩小容积)或使用催化剂对反应速率的影响
C. 图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
D. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
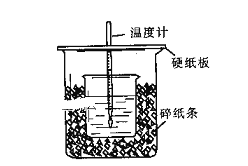
(1)从实验装置上看,图中尚缺少的一种玻璃用品是:______________。
(2)烧杯间填满碎纸条的作用是:_____________________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值___________(填“偏大、偏小、无影响”)
(4)加入NaOH溶液的正确操作是_____________(填字母).
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(5)上述实验测得的结果与书上的57.3kJ/mol有偏差,产生偏差的原因可能是______________
a.实验装置保温、隔热效果差
b.NaOH溶液倒入盛有硫酸的小烧杯中后未及时将盖板盖好.
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(6)若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量_______(填“小于”、“等于”或“大于”)57.3kJ
(7)已知:CH3COOH(aq)与NaOH(aq)反应的△H=﹣12.1kJmol﹣1;HCl(aq)与NaOH(aq)反应的△H=﹣55.6kJmol﹣1.则CH3COOH在水溶液中电离的△H等于______________.
A.﹣67.7kJmol﹣1 B.﹣43.5kJmol﹣1 C.+43.5kJmol﹣1 D.+67.7kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料在线:查阅资料可知如表所示数据:
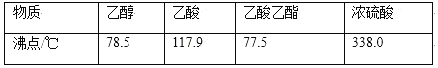
[实验步骤]
某学生在实验室制取乙酸乙酯的主要步骤如下:
①在30 mL的大试管A中按体积比1∶4∶4配制浓硫酸、乙醇和乙酸的混合溶液;
②按如图所示连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10 min;
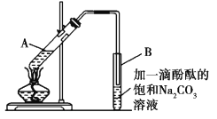
③待试管B收集到一定量的产物后停止加热,撤去试管B并用力振荡,然后静置待分层;
④分离出乙酸乙酯层、洗涤、干燥。
请根据题目要求回答下列问题:
(1)步骤①配制该混合溶液的主要操作步骤为___;写出制取乙酸乙酯的化学方程式:___。
(2)步骤②中需要小火均匀加热,其主要理由是________。
(3)指出步骤③所观察到的现象:________;
分离出乙酸乙酯后,为了干燥乙酸乙酯可选用的干燥剂为____(填字母)。
A.P2O5 B.无水Na2SO4
C.碱石灰 D.NaOH固体
(4)某化学课外小组设计了如图所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与上图装置相比,此装置的主要优点有______。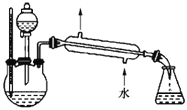
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu 与浓硝酸反应生成氮的氧化物,这些氧化物恰好溶解在NaOH 溶液中得到NaNO3和NaNO2的混合溶液,反应过程及有关数据如图所示:
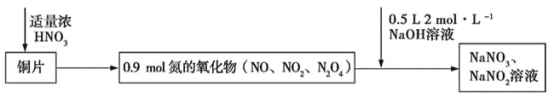
下列有关判断正确的是
A.若铜片为51.2 g,则生成0.2 mol NaNO3
B.常温下,Cu 遇浓硝酸发生钝化,不可能发生上述反应
C.标准状况下收集的氮氧化物为20.16 L
D.反应过程中生成的Cu(NO3)2既是氧化产物,也是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的质量分数,设计如下两种实验方案。
(1)已知AlN与NaOH反应得到一种盐和一种碱性气体,化学反应方程式是____
(方案1)取一定量的样品,用图1装置测定样品中AlN的质量分数(夹持仪器已略去)。
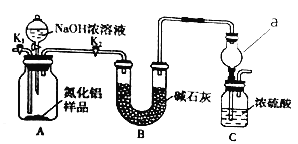
(2)图1中仪器a的名称是___
(3)完成以下实验步骤:组装好实验装置,首先检查装置气密性,再加入实验药品。关闭K1,打开K2和分液漏斗活塞,加入NaOH浓溶液至不再产生气体,打开K1,通入氮气一段时间,测定C装置在反应前后的质量变化。通入氮气的目的是____
(4)由于装置存在缺陷,导致测定结果偏高,请提出改进意见____
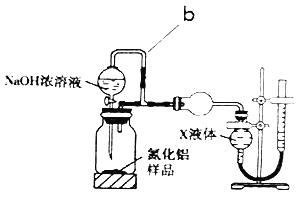
(方案2)用图2装置测定mg样品中AlN的质量分数(部分夹持装置己略去)。
(5)为测定生成气体的体积,量气装置中的X液体可以是___(填字母序号)。
a.CCl4 b.H2O c.饱和NH4Cl溶液 d.苯
(6)若mg样品完全反应,测得生成气体的体积为VmL(标准状况),则AlN的质量分数为___。若将b处胶管用弹簧夹夹住,其他操作均不变,则最终测定的结果___(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃以任意比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中不符合此条件的是 ( )
A.CH4 C2H4B.CH4 C3H4C.C2H4 C3H4D.C2H2 C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】400K、![]() 时,2L烃A的蒸气能在
时,2L烃A的蒸气能在![]() 氧气中完全燃烧,反应后体积增至
氧气中完全燃烧,反应后体积增至![]() 体积在同前的条件下测定
体积在同前的条件下测定![]() 请回答:
请回答:
(1)烃A在组成上应满足的条件是______.
(2)当![]() 时,该烃可能的分子式为______.
时,该烃可能的分子式为______.
(3)若A在常温常压下为气态,V的取值范围是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:
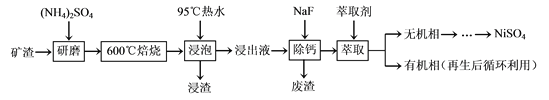
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。
(1)焙烧过程中NiFe2O4发生反应的化学方程式是___。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为___,“浸渣”的成分除Fe2O3、FeO(OH)、Fe(OH)3外还含有___、___(填化学式)。
(3)“浸泡”过程中温度低于95℃,可能导致的主要问题有___(写出一点即可)。
(4)“浸出液”中c(Ca2+)=1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-)=___mol·L-1。[已知Ksp(CaF2)=4.0×10-11]
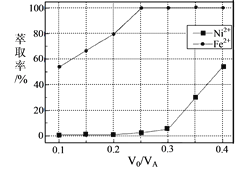
(5)本工艺中,萃取剂与溶液的体积比(![]() )对溶液中Ni2+、Fe2+的萃取率影响如图所示,
)对溶液中Ni2+、Fe2+的萃取率影响如图所示,![]() 的最佳取值是___。
的最佳取值是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com