
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
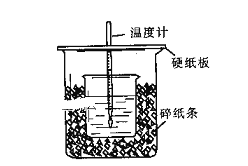
(1)从实验装置上看,图中尚缺少的一种玻璃用品是:______________。
(2)烧杯间填满碎纸条的作用是:_____________________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值___________(填“偏大、偏小、无影响”)
(4)加入NaOH溶液的正确操作是_____________(填字母).
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(5)上述实验测得的结果与书上的57.3kJ/mol有偏差,产生偏差的原因可能是______________
a.实验装置保温、隔热效果差
b.NaOH溶液倒入盛有硫酸的小烧杯中后未及时将盖板盖好.
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(6)若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量_______(填“小于”、“等于”或“大于”)57.3kJ
(7)已知:CH3COOH(aq)与NaOH(aq)反应的△H=﹣12.1kJmol﹣1;HCl(aq)与NaOH(aq)反应的△H=﹣55.6kJmol﹣1.则CH3COOH在水溶液中电离的△H等于______________.
A.﹣67.7kJmol﹣1 B.﹣43.5kJmol﹣1 C.+43.5kJmol﹣1 D.+67.7kJmol﹣1
【答案】环形玻璃搅拌棒 保温,防止热散失 偏小 B abc 大于 C
【解析】
(1)根据量热计的构造来判断该装置的缺少仪器;
(2)中和热测定实验成败的关键是保温工作;
(3)不盖硬纸板,会有一部分热量散失;
(4)将NaOH溶液倒入小烧杯中,不能分几次倒入,否则会导致热量散失,影响测定结果;
(5)a.装置保温、隔热效果差,测得的热量偏小;
b.将NaOH溶液倒入小烧杯中,不能分几次倒入,否则会导致热量散失;
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液温度,H2SO4的起始温度偏高;
(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;
故答案为:环形玻璃搅拌棒;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,故答案为:保温,防止热散失;
(3))大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小;
故答案为:偏小;
(4)倒入氢氧化钠溶液时,必须一次迅速的倒入,目的是减少热量的散失,不能分几次倒入氢氧化钠溶液,否则会导致热量散失,影响测定结果;
故答案为:B;
(5)a.装置保温、隔热效果差,测得的热量偏小,则测定的中和热的数值偏小,故a正确;
b.尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,分多次把NaOH溶液倒入盛有硫酸的小烧杯中,会导致热量散失较多,则测定的中和热的数值偏小,故b正确;
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液温度,H2SO4的起始温度偏高,温度差偏小,中和热的数值偏小,故c正确;
故选:abc;
(6)浓硫酸稀释放热,反应后的温度偏高,温度差偏大,所测得中和热的数值偏大,故答案为:大于;
(7)根据题意可得如下热化学方程式:CH3COOH (aq) + OH-(aq)= CH3COO-(aq) + H2O(l) ΔH=-12.1 kJ·mol-1,H+(aq) + OH-(aq)=H2O(l) ΔH=-55.6 kJ·mol-1,依据盖斯定律上面第一个式子减第二个式子,得到:CH3COOH (aq)H+(aq )+ CH3COO-(aq) ΔH=(-12.1 kJ·mol-1)-(-55.6 kJ·mol-1)=+43.5 kJ·mol-1综上所述,故选:C。


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】能证明乙烯分子里含有一个碳碳双键的事实是( )
A.乙烯分子里碳氢原子个数之比为1∶2
B.乙烯完全燃烧生成的CO2和H2O的物质的量相等
C.乙烯能使酸性KMnO4溶液褪色
D.乙烯易与溴水发生加成反应,且1mol乙烯完全加成消耗1mol溴单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室用如图所示的装置来制取乙酸乙酯。请回答下列问题:
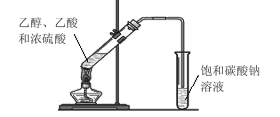
①试管中加入乙醇、乙酸和浓硫酸的顺序是_______;
②浓硫酸的作用是_________;
③饱和碳酸钠溶液的主要作用____;
④装置中通蒸气的导管只能插到饱和碳酸钠溶液的液面处,不能插入溶液中,目的____,长导管的作用是________。
⑤若要把制得的乙酸乙酯分离出来,应采用的实验操作是_________。
⑥进行该实验时,最好向试管甲中加入几块碎瓷片,其目的是______。
⑦生成乙酸乙酯的反应是可逆反应,反应物不能完全转化为生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态。下列描述不能说明该反应已达到化学平衡状态的是(填序号)______。
A 单位时间里,生成1mol乙酸乙酯,同时生成1mol水
B 单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
C 单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
D 正反应的速率与逆反应的速率相等
E 混合物中各物质的浓度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果醋是一种由苹果汁发酵而成的酸性饮品,具有解毒、降脂等药效。苹果酸是一种常见的有机酸,其结构简式为![]() 。
。
(1)苹果酸的分子式为___。
(2)1mol苹果酸与足量金属钠反应,能生成标准状况下的氢气___L。
(3)苹果酸可能发生的反应是___(填序号)。
A.与NaOH溶液反应
B.与石蕊试液作用
C.与乙酸在一定条件下发生酯化反应
D.与乙醇在一定条件下发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的实验装置可用来测定含两种元素的某种气体X的分子式。
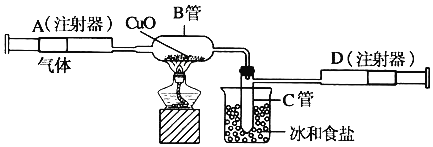
在注射器A中装有260毫升气体X并慢慢通过不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到以下实验结果:实验前B管重![]() 克,实验后B管重
克,实验后B管重![]() 克,B管中的黑色粉末变成红色粉末。在C管中收集到的无色液体是水;在注射器D中收集到的气体是氮气。试回答下列问题:
克,B管中的黑色粉末变成红色粉末。在C管中收集到的无色液体是水;在注射器D中收集到的气体是氮气。试回答下列问题:
(1)X气体是由______和______元素组成的。
(2)若260毫升X气体完全反应后,收集到的氮气质量是0.28克。根据实验时温度和压强计算1摩尔X气体的体积是26000毫升,则X的摩尔质量是______克/摩尔。
(3)通过计算,确定X的分子式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100mL甲气体经过下图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为![]()
![]()
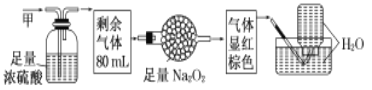
A.NO2、NH3、N2B.NH3、NO、CO2
C.NH3、NO2、CO2D.NH3、NO、N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海带中提取碘,可经过以下实验步骤完成。下列有关说法正确的是( )
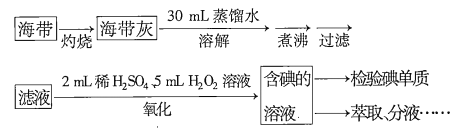
A.灼烧过程中使用的玻璃仪器有酒精灯、烧杯、玻璃棒
B.氧化过程中发生反应的离子方程式为![]()
C.检验碘单质时,可选用淀粉,若淀粉变蓝说明海带中一定含有碘单质
D.分液时,先打开活塞放出下层液体,再关闭活塞,从上口倒出上层液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,用
时,用![]() 二元弱酸
二元弱酸![]() 溶液滴定
溶液滴定![]() 溶液所得滴定曲线如图。下列说法不正确的是
溶液所得滴定曲线如图。下列说法不正确的是![]()
![]()

A.点![]() 所示溶液中:
所示溶液中:![]()
B.点![]() 所示溶液中:
所示溶液中:![]()
C.点![]() 所示溶液中:
所示溶液中:![]()
D.滴定过程中可能出现:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com