
【题目】![]() 时,用
时,用![]() 二元弱酸
二元弱酸![]() 溶液滴定
溶液滴定![]() 溶液所得滴定曲线如图。下列说法不正确的是
溶液所得滴定曲线如图。下列说法不正确的是![]()
![]()

A.点![]() 所示溶液中:
所示溶液中:![]()
B.点![]() 所示溶液中:
所示溶液中:![]()
C.点![]() 所示溶液中:
所示溶液中:![]()
D.滴定过程中可能出现:![]()
【答案】B
【解析】
![]() 时,用
时,用![]() (二元弱酸)溶液滴定
(二元弱酸)溶液滴定![]() 溶液,发生的反应为:
溶液,发生的反应为:![]() 、
、![]() 。
。
A.点![]() 所示的溶液的体积25mL,草酸和氢氧化钠恰好完全反应,生成正盐草酸钠,草酸钠水解,所以溶液中,
所示的溶液的体积25mL,草酸和氢氧化钠恰好完全反应,生成正盐草酸钠,草酸钠水解,所以溶液中,![]() ,根据电荷守恒得关系式为:
,根据电荷守恒得关系式为:![]() ,将①代入②得:
,将①代入②得:![]() ,故A正确;
,故A正确;
B.点②溶液中,溶液呈中性,为草酸钠和草酸的混合溶液,![]() ,根据电荷守恒得关系式为:
,根据电荷守恒得关系式为:![]() ,将①代入②得
,将①代入②得![]() ,草酸体积大于25mL,
,草酸体积大于25mL,![]() ,故B错误;
,故B错误;
C.点③所示的溶液的体积50mL,草酸过量,溶液溶质为![]() ,溶液呈酸性,草酸氢根离子的电离大于草酸氢根离子的水解,所以
,溶液呈酸性,草酸氢根离子的电离大于草酸氢根离子的水解,所以![]() ,故C正确;
,故C正确;
D.点①为草酸钠成碱性,点②溶液呈中性为草酸钠、草酸氢钠,点③溶液呈酸性,介于②和③之间,随着草酸的滴入,![]() 逐渐增多,所以可出现
逐渐增多,所以可出现![]() ,故D正确;
,故D正确;
故选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
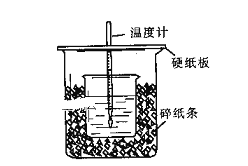
(1)从实验装置上看,图中尚缺少的一种玻璃用品是:______________。
(2)烧杯间填满碎纸条的作用是:_____________________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值___________(填“偏大、偏小、无影响”)
(4)加入NaOH溶液的正确操作是_____________(填字母).
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(5)上述实验测得的结果与书上的57.3kJ/mol有偏差,产生偏差的原因可能是______________
a.实验装置保温、隔热效果差
b.NaOH溶液倒入盛有硫酸的小烧杯中后未及时将盖板盖好.
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(6)若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量_______(填“小于”、“等于”或“大于”)57.3kJ
(7)已知:CH3COOH(aq)与NaOH(aq)反应的△H=﹣12.1kJmol﹣1;HCl(aq)与NaOH(aq)反应的△H=﹣55.6kJmol﹣1.则CH3COOH在水溶液中电离的△H等于______________.
A.﹣67.7kJmol﹣1 B.﹣43.5kJmol﹣1 C.+43.5kJmol﹣1 D.+67.7kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃以任意比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中不符合此条件的是 ( )
A.CH4 C2H4B.CH4 C3H4C.C2H4 C3H4D.C2H2 C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】400K、![]() 时,2L烃A的蒸气能在
时,2L烃A的蒸气能在![]() 氧气中完全燃烧,反应后体积增至
氧气中完全燃烧,反应后体积增至![]() 体积在同前的条件下测定
体积在同前的条件下测定![]() 请回答:
请回答:
(1)烃A在组成上应满足的条件是______.
(2)当![]() 时,该烃可能的分子式为______.
时,该烃可能的分子式为______.
(3)若A在常温常压下为气态,V的取值范围是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图装置中,烧瓶中充满干燥气体a,将胶头滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。a和b分别可以是
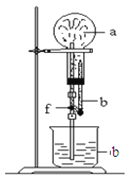
干燥气体a | 液体b | |
A | NO2 | 水 |
B | C12 | 饱和食盐水 |
C | NH3 | 水 |
D | CO2 | 4 mol·L—1NaOH溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如可利用NaOH溶液来“捕捉”CO2,其基本过程如图所示(部分条件及物质未标出)。
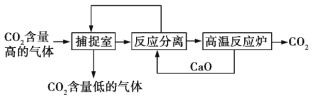
下列有关该方法的叙述中正确的是
①能耗小是该方法的一大优点
②整个过程中,有两种物质可以循环利用
③“反应分离”环节中,分离物质的基本操作是过滤、蒸发、结晶
④该方法可减少碳排放,“捕捉”到的CO2还可用来制备甲醇等产品
A.①③B.②④C.③④D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,三个烧瓶分别盛①等体积的NH3和N2的混合气、②等体积的NO2与O2的混合气、③纯净的NO2气体,将它们分别倒置于盛足量水的水槽中,当水进入烧瓶中,并使气体充分溶解,假定烧瓶中溶液无损失,所得溶液的物质的量浓度之比为
A.5:4:5B.1:1:1C.15:10:12D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
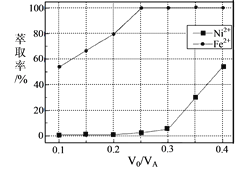
【题目】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:
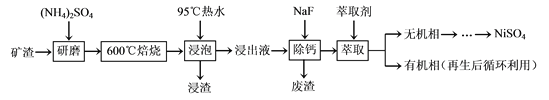
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。
(1)焙烧过程中NiFe2O4发生反应的化学方程式是___。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为___,“浸渣”的成分除Fe2O3、FeO(OH)、Fe(OH)3外还含有___、___(填化学式)。
(3)“浸泡”过程中温度低于95℃,可能导致的主要问题有___(写出一点即可)。
(4)“浸出液”中c(Ca2+)=1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-)=___mol·L-1。[已知Ksp(CaF2)=4.0×10-11]
(5)本工艺中,萃取剂与溶液的体积比(![]() )对溶液中Ni2+、Fe2+的萃取率影响如图所示,
)对溶液中Ni2+、Fe2+的萃取率影响如图所示,![]() 的最佳取值是___。
的最佳取值是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
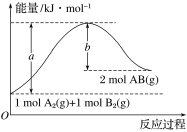
【题目】写出下列反应的热化学方程式。
(1)已知断开1molH—H键、1molN—H键、1molN≡N键需要的能量分别是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_______________________________
(2)已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,请写出该反应的热化学方程式:_______________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com