
【题目】无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100mL甲气体经过下图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为![]()
![]()
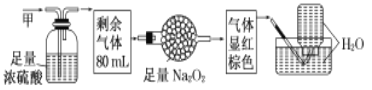
A.NO2、NH3、N2B.NH3、NO、CO2
C.NH3、NO2、CO2D.NH3、NO、N2
科目:高中化学 来源: 题型:
【题目】反应:2NO(g) + O2(g)![]() 2NO2(g) △H<0达平衡后,若分别采取下列措施;①增大压强 ② 减小NO2的浓度 ③增大O2浓度、④升高温度 ⑤加入催化剂,能使平衡向正向移动的是
2NO2(g) △H<0达平衡后,若分别采取下列措施;①增大压强 ② 减小NO2的浓度 ③增大O2浓度、④升高温度 ⑤加入催化剂,能使平衡向正向移动的是
A.①②③B.②③④C.③④⑤D.①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃,从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:
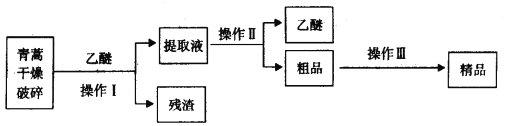
请回答下列问题:
(1)对青蒿进行干燥破碎的目的是______。
(2)操作I需要的玻璃仪器主要有:烧杯、______。
(3)在操作Ⅱ的蒸馏操作中,仪器选择及安装都正确的是______(填标号)。
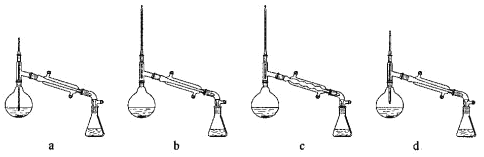
(4)操作Ⅲ的主要过程可能是______(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(5)用下列实验装置测定青蒿素分子式的方法如下:将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。
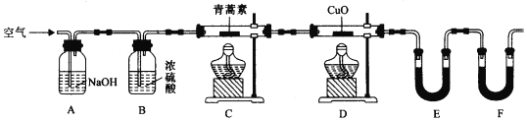
①装置E中盛放的物质是______,装置F中盛放的物质是______。
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是______。
③用合理改进后的装置进行试验,称得:
装置 | 实验前 | 实验后 |
E |
|
|
F |
|
|
则测得青蒿素的最简式是______。
(6)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与______(填字母)具有相同的性质。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
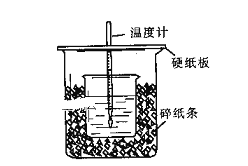
(1)从实验装置上看,图中尚缺少的一种玻璃用品是:______________。
(2)烧杯间填满碎纸条的作用是:_____________________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值___________(填“偏大、偏小、无影响”)
(4)加入NaOH溶液的正确操作是_____________(填字母).
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(5)上述实验测得的结果与书上的57.3kJ/mol有偏差,产生偏差的原因可能是______________
a.实验装置保温、隔热效果差
b.NaOH溶液倒入盛有硫酸的小烧杯中后未及时将盖板盖好.
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(6)若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量_______(填“小于”、“等于”或“大于”)57.3kJ
(7)已知:CH3COOH(aq)与NaOH(aq)反应的△H=﹣12.1kJmol﹣1;HCl(aq)与NaOH(aq)反应的△H=﹣55.6kJmol﹣1.则CH3COOH在水溶液中电离的△H等于______________.
A.﹣67.7kJmol﹣1 B.﹣43.5kJmol﹣1 C.+43.5kJmol﹣1 D.+67.7kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.PCl3、Cl2O、SF2分子中各原子最外层都具有8电子稳定结构
B.H2O分子比H2S分子稳定是因为前者分子间存在氢键
C.干冰和氯化铵分别受热变为气体,克服的微粒间作用力相同
D.CH3CH2OH和CH3OCH3相对分子质量相同,因而沸点几乎相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料在线:查阅资料可知如表所示数据:
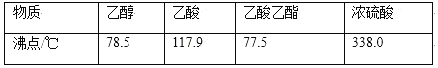
[实验步骤]
某学生在实验室制取乙酸乙酯的主要步骤如下:
①在30 mL的大试管A中按体积比1∶4∶4配制浓硫酸、乙醇和乙酸的混合溶液;
②按如图所示连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10 min;
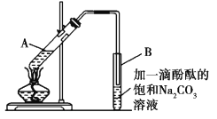
③待试管B收集到一定量的产物后停止加热,撤去试管B并用力振荡,然后静置待分层;
④分离出乙酸乙酯层、洗涤、干燥。
请根据题目要求回答下列问题:
(1)步骤①配制该混合溶液的主要操作步骤为___;写出制取乙酸乙酯的化学方程式:___。
(2)步骤②中需要小火均匀加热,其主要理由是________。
(3)指出步骤③所观察到的现象:________;
分离出乙酸乙酯后,为了干燥乙酸乙酯可选用的干燥剂为____(填字母)。
A.P2O5 B.无水Na2SO4
C.碱石灰 D.NaOH固体
(4)某化学课外小组设计了如图所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与上图装置相比,此装置的主要优点有______。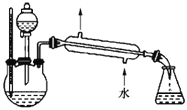
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu 与浓硝酸反应生成氮的氧化物,这些氧化物恰好溶解在NaOH 溶液中得到NaNO3和NaNO2的混合溶液,反应过程及有关数据如图所示:
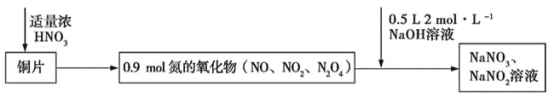
下列有关判断正确的是
A.若铜片为51.2 g,则生成0.2 mol NaNO3
B.常温下,Cu 遇浓硝酸发生钝化,不可能发生上述反应
C.标准状况下收集的氮氧化物为20.16 L
D.反应过程中生成的Cu(NO3)2既是氧化产物,也是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃以任意比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中不符合此条件的是 ( )
A.CH4 C2H4B.CH4 C3H4C.C2H4 C3H4D.C2H2 C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,三个烧瓶分别盛①等体积的NH3和N2的混合气、②等体积的NO2与O2的混合气、③纯净的NO2气体,将它们分别倒置于盛足量水的水槽中,当水进入烧瓶中,并使气体充分溶解,假定烧瓶中溶液无损失,所得溶液的物质的量浓度之比为
A.5:4:5B.1:1:1C.15:10:12D.无法计算
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com