
【题目】科学家正在研究将汽车尾气中的NO和CO转变为![]() 和
和![]() ,反应如下:
,反应如下:![]() ;
;![]() 一定条件下,在密闭容器中,反应达到平衡后,为提高该反应的反应速率和NO的转化率,采取的正确措施是
一定条件下,在密闭容器中,反应达到平衡后,为提高该反应的反应速率和NO的转化率,采取的正确措施是
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入![]() D.降低温度同时移出
D.降低温度同时移出![]()
科目:高中化学 来源: 题型:
【题目】一定温度下,在一固定体积的密闭容器中,对于可逆反应A(s)+3B(g)![]() 2C(g),下列说法不能说明达到化学平衡状态的是
2C(g),下列说法不能说明达到化学平衡状态的是
A. 气体密度不再变化 B. 混合气体的总压强不再变化;
C. A、B、C的物质的量之比为1∶3∶2 D. 混合气体的平均相对分子质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是:

A. 图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B. 图2表示压强对可逆反应2A(g)+2B(g) ![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
C. 图3表示H2与O2发生反应过程中的能量变化,则氢气的燃烧热为241.8kJ·mo1ˉ1
D. 图4表示用水稀释等体积且pH相同的盐酸和醋酸,溶液导电性:a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将A g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示,在相同的条件下,将A g粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是
A. B.
B.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 下,某反应达到平衡,平衡常数
下,某反应达到平衡,平衡常数![]() 恒容时,升高温度,NO浓度减小.下列说法正确的是
恒容时,升高温度,NO浓度减小.下列说法正确的是
A.该反应的焓变为正值
B.恒温下减小压强,反应体系的颜色加深
C.升高温度,逆反应速率减小
D.该反应化学方程式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月1日是中华人民共和国成立70周年,国庆期间对大量盆栽鲜花施用了S-诱抗素制剂以保证鲜花盛开,利用下图所示的有机物X可生产S﹣诱抗素Y.下列说法不正确的是( )

A.1mol Y与1mol Br2反应的产物有4种
B.1mol Y与足量NaOH溶液反应,最多消耗3mol NaOH
C.1mol X最多能加成7mol H2
D.X可以发生氧化、取代、酯化、加聚、缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属腐蚀与防护的说法不正确的是

A.图①,放置于干燥空气中的铁钉不易生锈
B.图②,若断开电源,钢闸门将发生析氢腐蚀
C.图②,若将钢闸门与电源的负极相连,可防止钢闸门腐蚀
D.图③,若金属M 比 Fe 活泼,可防止输水管腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着人们对硒的性质深入认识及产品硒的纯度提高,硒的应用范围越来越广。某科学小组以硫铁矿生产硫酸过程中产生的含硒物料(主要含S、Se、Fe2O3、CuO、ZnO、SiO2等)提取硒,设计流程如下:
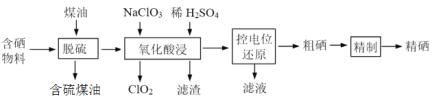
回答下列问题:
(1)“脱硫”时,测得脱硫率随温度的变化如图。随着温度的升高,脱硫率呈上升趋势,其原因是______。最佳温度是________。

(2)“氧化酸浸”中,Se转化成H2SeO3,该反应的离子方程式为________。
(3)采用硫脲[(NH2)2CS]联合亚硫酸钠进行“控电位还原”,将电位高的物质先还原,电位低的物质保留在溶液中,以达到硒与杂质金属的分离。下表是“氧化酸浸”液中主要粒子的电位。

①控制电位在0.740~1.511V范围内,在氧化酸浸液中添加硫脲,可选择性还原ClO2。该过程的还原反应(半反应)式为___________。
②为使硒和杂质金属分离,用亚硫酸钠还原时的最低电位应控制在_____V。
(4)粗硒的精制过程:Na2SO3浸出[Se转化成硒代硫酸钠(Na2SeSO3)]→Na2S净化→H2SO4酸化等步骤。
①净化后的溶液中c(Na2S)达到0.026 mol·L-1,此时溶液中的c(Cu2+)的最大值为________,精硒中基本不含铜。[Ksp(CuS)=1.3×10-36]
②硒代硫酸钠酸化生成硒的化学方程式为____________。
(5)对精硒成分进行荧光分析发现,精硒中铁含量为32 μg·g-1,则精硒中铁的质量分数为___________,与粗硒中铁含量为0.89%相比,铁含量明显降低。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是生产钛白的副产品,价格低,以硫酸亚铁为原料制备高效净水剂高铁酸钾(K2FeO4)可大大降低成本。其生产工艺如下:

已知:NaNO2是在空气中将Fe2+氧化为铁黄(FeOOH)的催化剂;铁黄微溶于酸。
请回答下列问题:
(1)铁黄(FeOOH)中铁元素的化合价是________。写出反应①生成铁黄(FeOOH)的离子方程式:____________________________,在通入O2“氧化”FeSO4的过程中,溶液的pH________(填“增大”“减小”或“不变”)
(2)写出反应③的化学方程式:___________________________________________。
(3)K2FeO4可作为新型多功能水处理剂的原因是_____________________________。
(4)该工艺每消耗标准状况下112LCl2理论上得到________gK2FeO4。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com