
【题目】将22.4g铜与100mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为6.72L,请回答:
(1)NO和NO2的体积各为多少?
(2)将盛有所得上述混合气体的容器倒扣在水中,通入标准状况下一定体积的O2恰好使气体完全溶于水中,则通入的O2的体积是多少?
【答案】
(1)解:设NO和NO2的体积分别为x L与yL,则x+y=22.4
由电子得失守恒:( ![]() )×3+(
)×3+( ![]() )×1=(
)×1=( ![]() )×2
)×2
解得x=4.48、y=2.24,
答:NO和NO2的体积分别为4.48L、2.24L
(2)解:生成的氮氧化物又和氧气反应生成硝酸,整个反应过程中Cu失去电子的物质的量等于氧气得到电子的物质的量,设氧气体积为VL,
根据转移电子守恒得n(Cu)×2= ![]() ×4
×4
即 ![]()
V=3.92,
答:消耗氧气体积在标况下是3.92L.
【解析】(1)设NO和NO2的体积分别为x L与yL,则x+y=22.4由电子得失守恒:( ![]() )×3+(
)×3+( ![]() )×1=(
)×1=( ![]() )×2据此计算两种气体体积;(2)生成的氮氧化物又和氧气反应生成硝酸,整个反应过程中Cu失去电子的物质的量等于氧气得到电子的物质的量,据此计算氧气体积.
)×2据此计算两种气体体积;(2)生成的氮氧化物又和氧气反应生成硝酸,整个反应过程中Cu失去电子的物质的量等于氧气得到电子的物质的量,据此计算氧气体积.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. 非金属氧化物都是酸性氧化物 B. 金属氧化物都是碱性氧化物
C. 氧气与臭氧属于同素异形体 D. 氧化物都可以直接和水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃ 时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( ) 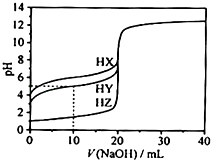
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX
B.根据滴定曲线,可得Ka(HY)≈10﹣5
C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X﹣)>c(Y﹣)>c(OH﹣)>c(H+)
D.HY与HZ混合,达到平衡时:c(H+)═ ![]() +c(Z﹣)+c(OH﹣)
+c(Z﹣)+c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,在强碱性溶液中可以大量共存的是
A.I-、AlO2-、H+、S2-B.Na+、K+、NH4+、Ba2+
C.Br-、S2-、Cl-、CO32-D.SO32-、NO3-、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量.下列反应对应的曲线错误的是( ) 
A.向NaAlO2溶液中滴入HCl至过量
B.向澄清石灰水中通入CO2至过量
C.向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量
D.向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至沉淀消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算:
(1)2.3g 乙醇含有个H原子,所含共价键的物质的量 , 其中所含官能团羟基的电子数为 .
(2)某条件下,8g氧气所占的体积为6L,则在该条件下的气体摩尔体积为 .
(3)100mL硫酸铝溶液中C(Al3+)=0.20mol/L(不考虑水解因素),则其中n(SO42﹣)= .
(4)在9.5g某二价金属的氯化物中含有0.2mol Cl﹣ , 此氯化物的摩尔质量为 .
(5)6.72L CO(标准状况)与一定量的Fe2O3恰好完全反应(生成Fe与CO2)后,生成Fe的质量为 g,转移的电子数目为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算:
(1)2.3g 乙醇含有个H原子,所含共价键的物质的量 , 其中所含官能团羟基的电子数为 .
(2)某条件下,8g氧气所占的体积为6L,则在该条件下的气体摩尔体积为 .
(3)100mL硫酸铝溶液中C(Al3+)=0.20mol/L(不考虑水解因素),则其中n(SO42﹣)= .
(4)在9.5g某二价金属的氯化物中含有0.2mol Cl﹣ , 此氯化物的摩尔质量为 .
(5)6.72L CO(标准状况)与一定量的Fe2O3恰好完全反应(生成Fe与CO2)后,生成Fe的质量为 g,转移的电子数目为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com