
(14分)4,7—二甲基香豆素(熔点:132.6℃)是一种重要的香料,广泛分布于植物界中,由间—甲苯酚为原料的合成反应如下: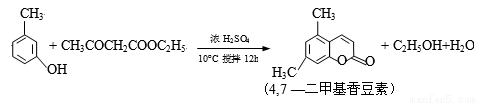
实验装置图如下:

主要实验步骤:
步骤1.向装置a中加入60mL浓硫酸,并冷却至0℃以下,搅拌下滴入间—甲苯酚30mL(0.29mol)和乙酰乙酸乙酯26.4mL (0.21mol)的混合物。
步骤2.保持在10℃下,搅拌12h,反应完全后,将其倒入冰水混合物中,然后抽滤、水洗得粗产品
步骤3.粗产品用乙醇溶解并重结晶,得白色针状晶体并烘干,称得产品质量为33.0g。
(1)图中仪器名称:a 。
(2)简述装置b中将活塞上下部分连通的目的 。
(3)浓H2SO4需要冷却至0℃以下的原因是 。
(4)反应需要搅拌12h,其原因是 。
(5)本次实验产率为 。
(6)实验室制备乙酸乙酯的化学反应方程式 ,用 (填药品名称)收集粗产品,用 (填操作名称)的方法把粗产品分离。
(14分)(1)三颈烧瓶 (1分)
(2)平衡上下气压,使漏斗中液体顺利流下(2分)
(3)防止浓H2SO4将有机物氧化或炭化 (2分)
(4)使反应物充分接触反应,提高反应产率 (2分)
(5)90.3% (2分)
(6)CH3CH2OH+CH3COOH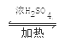 CH3COOCH2CH3+H2O (2分)
CH3COOCH2CH3+H2O (2分)
饱和的碳酸钠溶液(2分) 分液(1分)
【解析】
试题分析:(1)仪器a的名称为三颈烧瓶;(2)装置b中将活塞上下部分连通的目的是使漏斗的液面上下压强相同,使漏斗中液体在重力作用下可以顺利流下;(3)间甲基苯酚和乙酰乙酸乙酯在温度较高时容易被浓H2SO4氧化,冷却至0℃以下就可以防止浓H2SO4将有机物氧化或炭化;(4)反应需要搅拌12h,目的就是使反应物充分接触反应,提高反应产率;(5)由于30mL间—甲苯酚的物质的量是0.29mol,26.4mL乙酰乙酸乙酯的物质的量是0.21mol,二者反应时是按照1:1关系反应的。乙酰乙酸乙酯不足量,所以理论上可得)4,7—二甲基香豆素的物质的量是0.21mol,质量是0.21mol×174g/mol=36.54g。实际产量是33.0g,所以本次实验产率为(33.0g÷36.54g)×100%=90.3%;(6)在实验室中是用乙酸与乙醇在浓硫酸存在时加热发生酯化反应产生,制备乙酸乙酯的化学反应方程式是CH3CH2OH+ CH3COOH 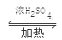 CH3COOCH2CH3+H2O;由于乙醇和乙酸容易挥发,产生的乙酸乙酯沸点也较低,所以从反应装置蒸发得到的是三种物质的混合物;可以通过导气管将混合物通到盛有饱和碳酸钠溶液的液面上,这样饱和碳酸钠溶液即可以溶解乙醇,反应消耗乙酸,同时降低乙酸乙酯的溶解度,得到互不相溶的两层液体物质,然后通过分液分离得到纯净的乙酸乙酯。
CH3COOCH2CH3+H2O;由于乙醇和乙酸容易挥发,产生的乙酸乙酯沸点也较低,所以从反应装置蒸发得到的是三种物质的混合物;可以通过导气管将混合物通到盛有饱和碳酸钠溶液的液面上,这样饱和碳酸钠溶液即可以溶解乙醇,反应消耗乙酸,同时降低乙酸乙酯的溶解度,得到互不相溶的两层液体物质,然后通过分液分离得到纯净的乙酸乙酯。
考点:考查物质的制取方法、混合物的分离、仪器的识别、作用、操作方法、物质的产率的计算的知识。


科目:高中化学 来源:2014-2015学年山东省菏泽市高三上学期期末考试化学B试卷(解析版) 题型:选择题
下列事实一定能说明HF是弱酸的是
①常温下NaF溶液的pH大于7 ②用HF溶液做导电性实验,灯泡很暗
③HF与NaCl不能发生反应 ④常温下0.1mol/L的HF溶液的pH为2.3
⑤HF能与Na2CO3溶液反应,产生CO2气体 ⑥HF与水能以任意比混溶
⑦1mol/L的HF水溶液能使紫色石蕊试液变红
A.①②⑦ B.②③⑤ C.③④⑥ D.①④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三下学期期初联考化学试卷(解析版) 题型:选择题
下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结 论 |
A | 向某溶液中先加氯水再加KSCN溶液 | 溶液呈血红色 | 原溶液中定含Fe2+ |
B | 向无色溶液中加盐酸酸化的BaCl2溶液 | 有白色沉淀 | 原溶液中定含SO42- |
C | 向Na2SiO3溶液中通入适量CO2气体 | 出现白色胶状沉淀 | 碳的非金属性大于硅 |
D | 用铂丝蘸取某物质的溶液进行焰色反应 | 火焰呈黄色 | 该物质定是钠盐 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省五市十校高三下学期3月模拟考试理综化学试卷(解析版) 题型:填空题
(14分)磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在电炉中高温(~1550℃)下通过下面三个反应共熔得到。
①4Ca3(PO4)2(s)+10C(s)=12CaO(s)+2P4(s)+10CO2(g)ΔH1=+Q1kJ·mol-1
②CaO(s)+SiO2(s)=CaSiO3(s) ΔH2=-Q2 kJ·mol-1
③CO2 (g)+C(s)=2CO(g) ΔH3=+Q3kJ·mol-1
已知:CaSiO3的熔点(1546℃)比SiO2低。
a、写出由磷酸钙矿制取白磷总的反应方程式_____________________________。
b、上述反应中SiO2起何作用?______________________________________。
(2)白磷在热的浓氢氧化钾溶液中岐化得到一种次磷酸盐(KH2PO2)和一种气体 (写化学式)。
(3)磷的重要化合物NaH2PO4可通过H3PO4与NaOH溶液反应获得。工业上为了使反应的主要产物是NaH2PO4,通常将pH控制在 之间(已知磷酸的各级电离常数为:K1= 7.1×103 K2 = 6.3×108 K3 =4.2×1013 lg7.1≈0.9 lg6.3≈0.8 lg≈0.6) 。Na2HPO4 溶液显碱性,若向溶液中加入足量的CaCl2 溶液,溶液则显酸性,其原因是 (用离子方程式表示)。
(4)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P 4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
60molCuSO4能氧化白磷的物质的量是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省五市十校高三下学期3月模拟考试理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法错误的是

A.一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA
B.256g S8分子中含S-S键为7NA个
C.由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个
D.1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA个
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省仙桃天门潜江高三上学期期末联考理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.水的离子积KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度
B.Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关
C.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4C1晶体,能使溶液的pH减小,c(NH4+)/c(NH3·H2O)的比值增大
D.室温下,CH3COOH的 ,NH3·H2O的
,NH3·H2O的 ,CH3COOH溶液中的c (H+)与NH3·H2O中的c(OH-)相等
,CH3COOH溶液中的c (H+)与NH3·H2O中的c(OH-)相等
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省八市高三年级三月联考理综化学试卷(解析版) 题型:填空题
(15分)氨基甲酸铵(H2NCOONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组用如下方法制备氨基甲酸铵,反应的化学方程式如下:
2NH3(g)+CO2(g) H2NCOONH4(s) ΔH<0
H2NCOONH4(s) ΔH<0
(1)实验室通常采用图1装置制取氨气,你所选择的试剂是 。
(2)制备氨基甲酸铵的装置如图2所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。

注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是 。
液体石蜡鼓泡瓶的作用是 。
②从反应后的混合物中分离出产品的实验方法 (填操作名称)。为了得到干燥产品,应采取的方法是________(填写选项序号)。
a.常压加热烘干 b.高压加热烘干 c.真空40 ℃以下烘干
③尾气处理装置如图3所示。能否将浓H2SO4改为稀H2SO4 (填“能”或“否”),理由是 。

(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.570 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为2.000 g。则样品中氨基甲酸铵的质量分数为_______。
[Mr(NH2COONH4)=78、Mr(NH4HCO3) =79、Mr(CaCO3)=100]
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省肇庆市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列反应的离子方程式正确的是
A.澄清的石灰水跟盐酸反应:H++OH-== H2O
B.铁和稀硫酸反应:2Fe + 6H+ =2Fe 3+ +3H 2↑
C.NaHCO3溶液与NaOH溶液反应: OH-+ HCO3-=CO32-+ H2O
D.金属钠跟水反应: Na+2H2O ==Na++2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广州市高一上学期期末考试化学试卷(解析版) 题型:选择题
以下关于混合物分离提纯操作或原理说法正确的是
A.实验室中用含有Ca2+、Mg2+、Cl-的自来水制取蒸馏水,可采用蒸馏的方法
B.用CCl4萃取碘水的实验中,振荡静置后,下层为紫红色溶液
C.利用植物油的密度比水小的原理,可用分液的方法分离这两种液体混合物
D.蒸馏时,温度计的水银球应充分接触溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com