
【题目】1942年,我国化工专家侯德榜以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱,他的“侯氏制碱法”为世界制碱工业做出了突出贡献。有关反应的化学方程式如下:
NH3+CO2+H2O=NH4HCO3;
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)“侯氏制碱法”把合成氨和纯碱两种产品联合生产,请写出工业合成氨的化学反应方程式_____。
(2)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是______。
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(3)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。
第一位同学:将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出)。

请回答:
①写出甲中发生反应的离子方程式______。
②乙装置中的试剂是______。
③实验结束后,分离出NaHCO3晶体的操作是______(填分离操作的名称)。
(4)第二位同学:用图中戊装置进行实验(其它装置未画出)。
①为提高二氧化碳在此反应溶液中被吸收的程度,实验时,须先从a管通入______气体,再从b管中通入______气体。
②装置c中的试剂为______(选填字母)。
e.碱石灰 f.浓硫酸 g.无水氯化钙
③若该同学进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为______。
【答案】N2+3H2![]() 2NH3 c CaCO3+2H+=Ca2++H2O+CO2↑ 饱和碳酸氢钠 过滤 NH3(氨) CO2(二氧化碳) g 60%
2NH3 c CaCO3+2H+=Ca2++H2O+CO2↑ 饱和碳酸氢钠 过滤 NH3(氨) CO2(二氧化碳) g 60%
【解析】
⑴工业合成氨是氢气和氮气反应生成氨气。
⑵碳酸氢铵、氯化钠易溶于水,因碳酸氢钠的溶解度相对较小。
⑶①甲中发生反应是碳酸钙和盐酸反应生成氯化钙、二氧化碳和水;②乙装置中主要是除掉挥发出的HCl杂质;③实验结束后,从溶液中分离出NaHCO3晶体。
⑷①为提高二氧化碳在此反应溶液中被吸收的程度,实验时,先通入氨气形成饱和溶液,氨气极易溶于水,要注意防倒吸,再通入二氧化碳气体反应;②装置c目的是除去杂质,碱石灰不能除掉氨气,浓硫酸是液体,不能装在干燥管中,无水氯化钙与氨气反应;③先根据NaCl~NaHCO3,得到理论生成NaHCO3质量,再计算NaHCO3的产率。
⑴工业合成氨是氢气和氮气反应生成氨气,其化学反应方程式N2+3H2![]() 2NH3;故答案为:N2+3H2
2NH3;故答案为:N2+3H2![]() 2NH3。
2NH3。
⑵碳酸氢铵、氯化钠易溶于水,因碳酸氢钠的溶解度相对较小,因此碳酸氢铵与饱和食盐水反应生成碳酸氢钠和氯化铵,溶液中析出碳酸氢钠;故答案为:c。
⑶①甲中发生反应是碳酸钙和盐酸反应生成氯化钙、二氧化碳和水,其离子方程式CaCO3+ 2H+ = Ca2++H2O+CO2↑;故答案为:CaCO3+2H+ = Ca2++H2O+CO2↑。
②乙装置中主要是除掉挥发出的HCl杂质,因此用饱和碳酸氢钠溶液除HCl;故答案为:饱和碳酸氢钠。
③实验结束后,从溶液中分离出NaHCO3晶体,因此分离出NaHCO3晶体的操作是过滤;故答案为:过滤。
⑷①为提高二氧化碳在此反应溶液中被吸收的程度,实验时,先通入氨气形成饱和溶液,氨气极易溶于水,要注意防倒吸,再通入二氧化碳气体反应,因此先从a管通入NH3气体,再从b管中通入CO2气体;故答案为:NH3(氨);CO2(二氧化碳)。
②装置c目的是除去杂质,碱石灰不能除掉氨气,浓硫酸是液体,不能装在干燥管中,无水氯化钙与氨气反应,因此c中的试剂为无水氯化钙;故答案为:g。
③若该同学进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,根据NaCl~NaHCO3,得到理论生成NaHCO3质量为![]() ,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为
,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为![]() ;故答案为:60%。
;故答案为:60%。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体的还原性,装置如图所示,下列说法不合理的是
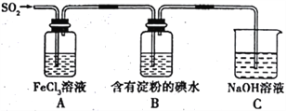
A. A装置中FeCl3溶液逐渐变为浅绿色,可以说明SO2有还原性
B. B装置中蓝色退去,说明还原性:SO2>I-
C. C装置中吸收尾气有可能倒吸
D. A、B装置中发生的反应转移电子数一定相等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双氧水是一种重要的绿色试剂,工业上可采取电解较稀浓度的硫酸来制取双氧水(H2O2为还原产物),其电解的化学方程式为:3H2O+3O2![]() O3+3H2O2。下列有关说法正确的是
O3+3H2O2。下列有关说法正确的是
A. 电解池的阳极生成双氧水,阴极生成臭氧
B. 电解池中H+移向阴极
C. 产生臭氧的电极反应式为3H2O+6e-=O3+6H+
D. 产生双氧水的电极反应式为2H2O-2e- =H2O2+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,有关稀氨水、铵盐溶液的叙述正确的是
A. 已知0 .10 mo1/ L氨水的电离度为1.32%,该溶液的pH=12
B. 向含有NaOH和NH3·H2O的溶液中加入稀盐酸,溶液呈中性时c(Na+)=c(Cl-)
C. 向10 mL0.1 mo1/L的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中,![]() 将增大
将增大
D. 浓度均为0.1 mol/L的下列溶液①NH4HSO4②NH4Al(SO4)2③NH4Cl④(NH4)2SO4中c(NH4+)的大小关系为①>②>④>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25 ℃时, Kb(NH3·H2O)=1.8×10-5。 该温度下,用 0.100mol·L-1 的氨水滴定 10.00 mL 0.100mol·L-1 的一元酸 HA 的溶液, 滴定过程中加入氨水的体积(V)与溶液中 的关系如图所示。下列说法不正确的是

A. HA 为强酸
B. a=10
C. 25 ℃时,NH4+的水解平衡常数为![]()
D. 当滴入 20 mL 氨水时,溶液中存在 c(NH4+)>c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某食用香料乙酸橙花酯的结构简式如图所示,则关于该有机物叙述中正确的个数是( )

①分子式为C12H20O2 ②它的同分异构体中有芳香族化合物 ③能使酸性KMnO4溶液褪色 ④1mol该有机物在一定条件下能和3mol H2反应 ⑤密度比水小 ⑥1mol该有机物水解时能消耗1molNaOH⑦能在一定条件下生成高分子化合物
A. 3个 B. 4个 C. 5个 D. 6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锶(Sr)为第5周期ⅡA族元素。高纯六水氯化锶晶体(SrCl2.6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水。用工业碳酸锶粉末(含少量Ba、Fe的化合物等杂质)制备高纯六水氯化锶晶体的过程如下图所示。

请回答:
(1)常温下,氯化锶溶液pH____7(填“大于”、“等于”或“小于”);
(2)步骤③所得滤渣的主要成分是______(填化学式),调节溶液pH至8~10,宜选用的试剂为 ______。
A.稀硫酸 B.氢氧化锶粉末 C.氢氧化钠 D.氧化锶粉末
(3)步骤⑤中,洗涤氯化锶晶体最好选用____。
A.水 B.稀硫酸 C.氢氧化钠溶液 D.氯化锶饱和溶液
(4)工业上用热风吹干六水氯化锶,选择的适宜温度范围是____(填字母)。
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
(5)若滤液中Ba2+浓度为1×10-6 mol/L,依据下表数据可以推算滤液中Sr2+物质的量浓度为 ________。
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把1.0mol/L CuSO4溶液、1.0mol/L Fe2(SO4)3溶液两种溶液等体积混合(假设混合后液体的体积等于混合前两种溶液的体积之和),向溶液中加入足量铁粉,经足够长的时间后,铁粉有剩余.此时溶液中Fe2+的物质的量浓度为
A. 1.0 mol/L B. 2.0 mol/L C. 3.0 mol/L D. 4.0 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短同期元素,最高正价依次为+1、+4、+5、+7,其核电荷数按B、C、A、D的顺序增大。已知B、C的次外层电子数为2,D、A的次外层电子数均为8,且A、D原子的电子层数相同。请回答:
(1)写出A、B、C、D的元素符号:A___、B___、C___、D___。
(2)画出A的原子结构示意图:___;
(3)写出AD的电子式:___;
(4)写出A、C的最高价氧化物对应水化物相互反应的化学方程式:__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com