
����Ŀ����ʽ������[Fe(OH)SO4]��������ˮ����ýȾ���ȡ���ҵ�����÷���м(����������������������)������ʽ�������IJ��ֹ������£�
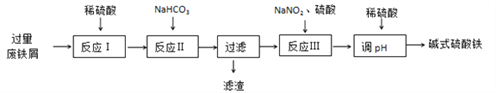
��֪������������������������ʽ����ʱ��Һ��pH���±���
������ | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
��ʼ���� | 2.3 | 7.5 | 3.4 |
��ȫ���� | 3.2 | 9.7 | 4.4 |
(1)��Ӧ����������ԭ��Ӧ�����ӷ���ʽ__________________ �� __________________��
(2)��Ӧ���м���NaHCO3������ϵ��pH��_____________��Χ�ڡ�
(3)��Ӧ�������ɵ����������������ɫ���÷�Ӧ�����ӷ���ʽ��_________________��
(4)����Ӧ����ͨ��O2�ɼ���NaNO2��������������1molO2�ɽ�Լn(NaNO2)=____mol��
(5)��ʽ����������ˮ�����ɵ�Fe(OH)2+���ӿɲ���ˮ������Fe2(OH)42+ �ۺ����ӣ���ˮ�ⷴӦ�����ӷ���ʽΪ____________________________
���𰸡� Fe +H+ ��Fe2+ + H2 �� Fe +2 Fe3+��3Fe2+ 4.4��pH<7.5 Fe2+ + NO2- +2H+ ��Fe3++ NO ��+H2O 4 2Fe��OH��2+ + 2H2O![]() Fe2��OH��42+ + 2H+
Fe2��OH��42+ + 2H+
�����������⿼�黯ѧ�������̣���1������м�к���Fe��Fe2O3��Al2O3����ӦI�м���ϡ���ᣬ����Al2O3��6H��=2Al3����3H2O��Fe2O3��6H��=2Fe3����3H2O��Fe��2Fe3��=3Fe2����Fe��2H��=Fe2����H2��������������ԭ��Ӧ�����ӷ���ʽΪFe��2Fe3��=3Fe2����Fe��2H��=Fe2����H2��������̼�����Ƶ�Ŀ���dz�ȥ����Al3�������pH���ڷ�Χ��4.4��pH<7.5����3�����ɵ����������������ɫ��˵�����ɵ�����ΪNO����������������������Fe2��������Fe3������������ԭΪNO�����ӷ�Ӧ����ʽΪ��Fe2�� + NO2�� +2H�� ��Fe3��+ NO ��+H2O����4��1molO2���뷴Ӧ���õ�4mol���ӣ��õ�4mol���ӣ���Ҫ����NaNO2�����ʵ���Ϊ4/1mol=4mol����5��������Ϣ���ó���2Fe��OH��2+ + 2H2O![]() Fe2��OH��42+ + 2H����
Fe2��OH��42+ + 2H����


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijNa2CO3��NaAlO2�Ļ����Һ����μ���1molL1�����ᣬ�����Һ�е�CO32��HCO3��AlO2��Al3+�����ʵ��������������Һ������仯��ϵ��ͼ��ʾ��������˵����ȷ���ǣ� ������֪��H2CO3�ĵ���ƽ�ⳣ��K1 = 4.3��107,K2 = 5.6��1011��Al(OH)3����ʽ����ƽ�ⳣ��K=6.3��1013��

A. a���߱�ʾ�����ӷ���ʽΪ��AlO2+4H+ = Al3+ + 2H2O
B. M��ʱ���ɵ�CO2Ϊ0.05 mol
C. ԭ�����Һ�е�CO32��AlO2�����ʵ���֮��Ϊ1:2
D. V1:V2=1:4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н�����ʵ�Ļ�ѧ����ʽ�����ӷ���ʽ�в���ȷ����
A. ʢ��NaOH��Һ���Լ�ƿ�����ò�������SiO2+2OH��=SiO32��+H2O
B. �ù���������ữ�ĺ����ҽ���Һ����ȡ�⣺2H++2I��+H2O2=I2+2H2O
C. ȼúʱ��������ʯ��ʯ��ĩ���ɼ���SO2���ŷţ�2CaCO3+2SO2+O2![]() 2CaSO4+2CO2
2CaSO4+2CO2
D. ǿ����Һ�У��ô���������Fe(OH)2��Ӧ�Ʊ��������ƣ�2ClO��+ Fe(OH)2=FeO42��+2Cl��+2H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ͼһ��ʾ���ǿ��淴ӦCO(g)��H2(g) ![]() C(s)��H2O(g) ��H��0�Ļ�ѧ��Ӧ����(v)��ʱ��(t)�Ĺ�ϵ��ͼ����ʾ���ǿ��淴Ӧ2NO2(g)
C(s)��H2O(g) ��H��0�Ļ�ѧ��Ӧ����(v)��ʱ��(t)�Ĺ�ϵ��ͼ����ʾ���ǿ��淴Ӧ2NO2(g) ![]() N2O4(g) ��H��0��Ũ��(c)��ʱ��t�ı仯���������˵������ȷ����
N2O4(g) ��H��0��Ũ��(c)��ʱ��t�ı仯���������˵������ȷ����

A��ͼһt2ʱ�ı�������������������¶Ȼ�ʹ���˴���
B����ͼһt2ʱ�ı������������ѹǿ����Ӧ�Ħ�H����
C��ͼ��t1ʱ�ı�������������������¶Ȼ�������ѹǿ
D����ͼ��t1ʱ�ı������������ѹǿ�����������ƽ����Է�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�ǰ�߸պ��Ǻ����������� (����)
A. 2 mol H2O��Ħ��������1 mol H2O��Ħ������
B. 200 mL 1 mol��L-1�Ȼ�����Һ��c(Cl-)��100 mL 2 mol��L-1�Ȼ�����Һ��c(Cl-)
C. 64 g������������ԭ�����ͱ�״����22.4 Lһ����̼����ԭ����
D. 20% NaOH��Һ��NaOH�����ʵ���Ũ�Ⱥ�10% NaOH��Һ��NaOH�����ʵ���Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʢ�������������ƹ�����Թ��еμ�ˮ��ֱ�����岻�ٷų�����ˮϡ�ͣ�ȡ����������Һ�����������������̣���������ų��������岻�ٷų����ٵμӷ�̪����Һ��졣���в²�����������
A���������ƺ�ˮ��Ӧ�����������ƺ�����
B���������ƺ�ˮ��Ӧ�IJ����ǹ������������
C�������������������̴������·ֽ�����������ˮ
D���������Ƹ�ˮ��Ӧ�����������ƺ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������F����һ�־��в�����ζ�ĸ��������ϳ�·�����£�
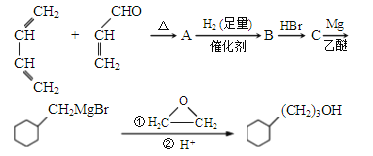


��1��A�Ľṹ��ʽΪ________��A�����������ŵ�������_____��
��2��A��B��Ӧ������________�� B��C��Ӧ����HBr֮���Ҫ���Լ���������________��
��3��E��ij��ͬ���칹���һ�ȴ���ֻ��һ�֣���ͬ���칹��Ľṹ��ʽΪ________��
��4��1mol������(F)��������Ӧ�������������____mol��
��5����������Ϣ������ϩ�ͻ������飨![]() ����Ϊԭ���Ʊ�1��������ƺϳ�·��________�������Լ���ѡ����
����Ϊԭ���Ʊ�1��������ƺϳ�·��________�������Լ���ѡ����
���ϳ�·�߳��ñ�ʾ����Ϊ��A ![]() B ����
B ����![]() Ŀ����
Ŀ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ɫ����������Һ�У��ܴ���������������ǣ� ��
A.Al3+��NH4+��Cl��HCO3B.Na+��NO3��SO42-��Fe2+
C.Na+��Mg2+��Cl��SO42-D.Fe3+��K+��Cl��NO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ����ʵ�ó�����Ӧ���۲���ȷ����
ѡ�� | ��ʵ | ���� |
A | ����������ͬ��Na2S2O3��Һ��H2SO4��Һ��Ӧ��������Һ���¶ȣ��������������ʱ������ | ��������������ʱ�����߷�Ӧ�¶ȣ���ѧ��Ӧ���ʼӿ� |
B | ��2.0 mLŨ�Ⱦ�Ϊ0.1 mol��L��1��KCl��KI�����Һ�еμ�1~2��0.01 mol��L��1AgNO3��Һ���������ʻ�ɫ | Ksp��AgCl��AgI |
C | 2NO2(g) | ��ѹƽ������������ɫ����ķ����ƶ� |
D | ��MgCl2��Һ���ɺ����գ��õ�MgO���� | ���ɵĹ�����ˮ�����ɵ�HCl�ӷ���ˮ���һ���ٽ�����Mg(OH)2�����պ����MgO |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com