
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.使甲基橙变黄色的溶液中:Na+、Al3+、![]() 、Cl-
、Cl-
B.0.1mol/L的烧碱溶液中:K+、Ba2+、Cl-、HCO3-
C.![]() =1×10-13 mol·L-1的溶液中:
=1×10-13 mol·L-1的溶液中:![]() 、Ca2+、Cl-、
、Ca2+、Cl-、![]()
D.水电离的c(H+)=1×10-13 mol·L-1的溶液中:K+、Na+、![]() 、
、![]()
【答案】C
【解析】
A.使甲基橙变黄色的溶液的pH>4.4,溶液可能为碱性,Al3+与氢氧根离子反应,在溶液中不能大量共存,A不符合题意;
B.烧碱就是氢氧化钠,0.1mol/L的烧碱溶液显碱性,氢氧根离子与HCO3-发生反应,在溶液中不能大量共存,B不符合题意;
C.常温下,![]() =1×10-13mol/L即
=1×10-13mol/L即![]() = c(OH-)=1×10-13mol/L,所以c(H+)=10-1mol/L,溶液显酸性,NH4+、Ca2+、Cl-、NO3-相互间不会发生反应,可以大量共存,C符合题意;
= c(OH-)=1×10-13mol/L,所以c(H+)=10-1mol/L,溶液显酸性,NH4+、Ca2+、Cl-、NO3-相互间不会发生反应,可以大量共存,C符合题意; ![]()
D.水电离的c(H+)=1×10-13mol·L-1,说明水的电离受到了抑制,溶液可能显酸性,也可能显碱性,酸性溶液中H+能与AlO2-、CO32-发生反应,不能大量共存,D不符合题意;
答案选C 。


科目:高中化学 来源: 题型:
【题目】近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为FeSmAsFO组成的化合物。回答下列问题:
(1)元素As与N同族。预测As的氢化物分子的立体结构为_______,其沸点比NH3的_______(填“高”或“低”),其判断理由是_________________________。
(2)Fe成为阳离子时首先失去______轨道电子,Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为______________________。
(3)比较离子半径:F__________O2(填“大于”等于”或“小于”)。
(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。
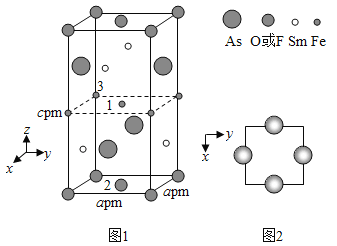
图中F和O2共同占据晶胞的上下底面位置,若两者的比例依次用x和1x代表,则该化合物的化学式表示为____________,通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=________g·cm3。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(![]() ),则原子2和3的坐标分别为__________、__________。
),则原子2和3的坐标分别为__________、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的两种物质互为同分异构体的有
①乙醇和二甲醚 ②正丁烷和异丁烷 ③金刚石和富勒烯 ④![]() 和
和![]() ⑤蔗糖和麦芽糖 ⑥蛋白质和氨基酸
⑤蔗糖和麦芽糖 ⑥蛋白质和氨基酸
A.③④⑥B.①②④C.①②⑤D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸是重要的化学试剂和工业原料。请回答下列问题:
(1)已知:25℃时,磷酸和氢氟酸的电离常数如下表所示。
物质 | H3PO4 | HF |
电离常数 | Ka1=7.1×103; Ka2=6.3×108; Ka3=4.2×1013 | Ka=6.6×104 |
向NaF溶液中滴加少量H3PO4溶液,反应的离子方程式为____________
(2)已知:
Ⅰ.CaO(s)+H2SO4(l)![]() CaSO4(s)+H2O(l) ΔH=-271kJ·mol1
CaSO4(s)+H2O(l) ΔH=-271kJ·mol1
Ⅱ.5CaO(s)+3H3PO4(l)+HF(g)![]() Ca5(PO4)3F(s)+5H2O(l) ΔH=-937kJ·mol1
Ca5(PO4)3F(s)+5H2O(l) ΔH=-937kJ·mol1
则:①工业上用Ca5(PO4)3F和硫酸反应制备磷酸的热化学方程式为____________。
②一定条件下,在密闭容器中只发生反应Ⅱ,达到平衡后缩小容器容积,HF的平衡转化率________(填“增大”“减小”或“不变”,下同);HF的平衡浓度________。
(3)工业上用磷尾矿制备Ca5(PO4)3F时生成的副产物CO可用于制备H2,原理为CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH。
CO2(g)+H2(g) ΔH。
①一定温度下,向10L密闭容器中充入0.5mol CO和1mol H2O(g),2min达到平衡时,测得0~2min内用CO2表示的反应速率v(CO2)=0.02mol·L1·min1。则CO的平衡转化率α=________;该反应的平衡常数K=________。
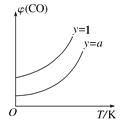
②在压强不变的密闭容器中发生上述反应,设起始的![]() =y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的ΔH___0(填“>”“<”或“=”,下同)。a_____1,理由为_____________
=y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的ΔH___0(填“>”“<”或“=”,下同)。a_____1,理由为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高良姜素是姜科植物高良姜根中的提取物,它能使鼠伤寒沙门氏菌TA98和TA100发生诱变,具有抗病菌作用.下列关于高良姜素的叙述正确的是( )
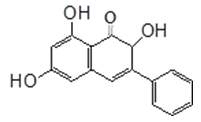
A.高良姜素的分子式为C15H15O5
B.高良姜素分子中含有3个羟基、8个双键
C.高良姜素能与碳酸钠溶液、溴水、酸性高锰酸钾溶液等反应
D.1mol高良姜素与足量的钠反应生成33.6LH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对大量盆栽鲜花施用了S﹣诱抗素制剂,以保持鲜花盛开,S﹣诱抗素的分子结构如图,下列关于该分子的说法中正确的是( )
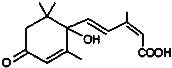
A. 含有碳碳双键、羟基、醛基、羧基
B. 能发生加成反应、氧化反应、取代反应、缩聚反应
C. 1mol该分子能与含2mol NaOH的溶液完全反应
D. 该分子能与溴水反应而使溴水褪色且1mol它能与溴水中的4mol Br2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多硫化钠Na2Sx(x≥2)在结构上与Na2O2、FeS2等有相似之处,Na2Sx在碱性溶液中可被NaClO氧化成Na2SO4,而NaClO被还原成NaCl,反应中Na2Sx与NaClO的物质的量之比为1:16,则x值是( )
A.5B.4C.3D.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用下图进行喷泉实验,已知圆底烧瓶内充满X气体,胶头滴管内装有少量Y液体,烧杯内装有足量Z液体,下列组合能进行喷泉实验且最终液体一定能充满整个烧瓶的是( )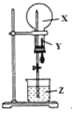
X气体 | Y试剂 | Z试剂 | |
A. | NO2 | H2O | H2O |
B. | CO2 | H2O | H2O |
C. | HCl | 饱和食盐水 | 水 |
D. | NO2 和O2 | H2O | H2O |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种重要的结构陶瓷材料,属于新型功能性陶瓷产品,它的硬度大、熔点高、化学性质稳定,工业上曾普遍采用高纯硅与纯氮在1300℃时反应获得。
(1)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应。试推测该陶瓷被氢氟酸腐蚀的化学方程式:_________。
(2)现用四氧化硅和氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅及氯化氢,反应的化学方程式为____。
(3)沸石是一种含结晶水的、具有多孔结构的铝硅酸盐,化学式为Na2[Al2Si3O10(H2O)2],若以氧化物形式可表示为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com