
【题目】多硫化钠Na2Sx(x≥2)在结构上与Na2O2、FeS2等有相似之处,Na2Sx在碱性溶液中可被NaClO氧化成Na2SO4,而NaClO被还原成NaCl,反应中Na2Sx与NaClO的物质的量之比为1:16,则x值是( )
A.5B.4C.3D.2
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】一定温度下的恒容密闭容器中,发生可逆反应2NO2(g)![]() 2NO(g)+O2(g)下面选项中不能作为达到化学平衡状态标志的是( )
2NO(g)+O2(g)下面选项中不能作为达到化学平衡状态标志的是( )
A.单位时间内生成nmolO2的同时生成2nmolNO2
B.混合气体的总压强不再变化
C.NO2、NO、O2的浓度之比为2∶2∶1
D.混合气体的颜色不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香豆素是广泛存在于植物中的一类芳香化合物,大多具有光敏性,有的还具有抗菌和消炎作用。它的核心结构是芳香内酯A,其分子式为C9H6O2,该芳香内酯A经下列步骤转变为水杨酸和化合物E。

已知:CH3CH=CHCH2CH3![]() CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH
请回答下列问题:
(1)A中官能团的名称为__________;化合物C的结构简式为__________。
(2)B生成C的反应类型为__________,化合物E的化学名称是__________。
(3)写出A→B的化学方程式:__________
(4)化合物D有多种同分异构体,其中一类同分异构体是苯的二元取代物,且水解后生成的产物之一能发生银镜反应,这类同分异构体共有__________种;写出其中核磁共振氢谱有5组峰,且峰面积之比为1:1:2:2:2的同分异构体的结构简式:__________。
(5)已知:R-CH=CH2![]() R-CH2CH2Br,请设计合理方案由
R-CH2CH2Br,请设计合理方案由 合成
合成 (其他无机原料自选,用反应流程图表示,并注明反应条件)___________________________。
(其他无机原料自选,用反应流程图表示,并注明反应条件)___________________________。
示例:原料![]() 产物
产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.使甲基橙变黄色的溶液中:Na+、Al3+、![]() 、Cl-
、Cl-
B.0.1mol/L的烧碱溶液中:K+、Ba2+、Cl-、HCO3-
C.![]() =1×10-13 mol·L-1的溶液中:
=1×10-13 mol·L-1的溶液中:![]() 、Ca2+、Cl-、
、Ca2+、Cl-、![]()
D.水电离的c(H+)=1×10-13 mol·L-1的溶液中:K+、Na+、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)三大合成材料______、______、______。
(2)下列有机物中属于脂肪烃的是______;属于芳香烃的是_____;属于苯的同系物的是______;属于脂环的是________。(填序号)
① ②
②![]() ③
③ ④
④![]() ⑤
⑤ ⑥
⑥
(3)实验室制取乙烯所用的乙醇为无水乙醇,但工业酒精中乙醇的含量为95%,将工业酒精转化为无水乙醇的方法是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盛有10mLNO2和O2的混合气体的量筒倒立于水槽中,充分反应后还剩余4mL无色气体,则剩余气体可能为( )
A.NO和O2B.NO或O2C.NOD.O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月9日,瑞典皇家科学院在斯德哥尔摩宣布,将2019年诺贝尔化学奖颁发给来自美国、英国、日本的三位科学家,表彰他们在锂离子电池方面的研究贡献。高度评价他们“创造了一个可充电的世界”。锂离子电池与传统电池相比,充电更快,功率密度更高,使用时间更长,在手机和笔记本电脑等便携式电子产品上广泛应用。工业上常以锂辉矿(主要成分为 LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂,其中一种工艺流程如下:

已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:

②Li2CO3的溶解度随温度变化如图所示:
试回答下列问题:
(1)酸浸时,为了提高浸取率可采取升高温度、粉碎矿石、搅拌、过滤后再次浸取等措施还可通过_______来提高浸取率。
(2)反应I中应调节pH范围为_______,沉淀A的成分除H2SiO3、CaCO3、Al(OH)3外,还有___________。
(3)反应Ⅱ的离子方程式为_________________。
(4)“操作I"的名称为______;洗涤Li2CO3沉淀要使用_______ (选填“热水”或“冷水”),理由是___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在隔绝空气的情况下,9.2 g铜、镁混合物溶解在一定量某浓度的稀硝酸中,当金属完全溶解后收集到标准状况下4.48 LNO气体。向反应后的溶液中加入足量的烧碱溶液,可生成氢氧化物沉淀的质量为
A.19.4 gB.18.6 gC.20 gD.24 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】形形色色的物质,构成了我们这个五彩缤纷的世界。世上万物,神奇莫测,常常超乎人们按“常理"的想象。学习物质结构和性质的知识,能使你想象的翅膀变得更加有力。
(1)基态Ga原子的核外电子排布式是[Ar]__,基态Ga原子核外电子占据最高能级的电子云轮廓图为___。
(2)HC≡CNa(乙炔钠)广泛用于有机合成,乙炔钠中C原子的杂化类型为___。乙炔钠中存在___(填字母)。
A.金属键 B.σ键 C.π键 D.氢键 E.配位键 F.离子键 G.范德华力
(3)NaN3是汽车安全气囊中的主要化学成分,其阴离子的立体构型为____。写出和该阴离子互为等电子体的一种分子的结构式___。
(4)钙和铁都是第四周期元素,且原子的最外层电子数相同,铁的熔沸点远高于钙,其原因是____。
(5)配体中配位原子提供孤电子对的能力与元素的电负性有关,SCN-的结构式可以表示为[S=C=N]-或[S-C≡N]-,SCN-与Fe3+、Au+和Hg2+等离子能形成配离子,N、C、S的电负性依次为3.0、2.5和2.5。SCN-中提供孤电子对的原子可能是___。
(6)某离子晶体的晶胞结构如图所示。
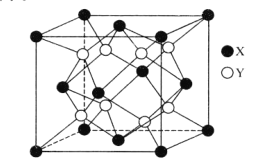
①晶体中在每个X周围与它最近且距离相等的X共有___个。
②设该晶体的摩尔质量为Mg·mol-1,晶胞的密度为ρg.cm-3,阿伏加德罗常数为NA,则晶体中两个最近的X间的距离为___cm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com