
【题目】在隔绝空气的情况下,9.2 g铜、镁混合物溶解在一定量某浓度的稀硝酸中,当金属完全溶解后收集到标准状况下4.48 LNO气体。向反应后的溶液中加入足量的烧碱溶液,可生成氢氧化物沉淀的质量为
A.19.4 gB.18.6 gC.20 gD.24 g
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列各组中的两种物质互为同分异构体的有
①乙醇和二甲醚 ②正丁烷和异丁烷 ③金刚石和富勒烯 ④![]() 和
和![]() ⑤蔗糖和麦芽糖 ⑥蛋白质和氨基酸
⑤蔗糖和麦芽糖 ⑥蛋白质和氨基酸
A.③④⑥B.①②④C.①②⑤D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多硫化钠Na2Sx(x≥2)在结构上与Na2O2、FeS2等有相似之处,Na2Sx在碱性溶液中可被NaClO氧化成Na2SO4,而NaClO被还原成NaCl,反应中Na2Sx与NaClO的物质的量之比为1:16,则x值是( )
A.5B.4C.3D.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用下图进行喷泉实验,已知圆底烧瓶内充满X气体,胶头滴管内装有少量Y液体,烧杯内装有足量Z液体,下列组合能进行喷泉实验且最终液体一定能充满整个烧瓶的是( )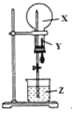
X气体 | Y试剂 | Z试剂 | |
A. | NO2 | H2O | H2O |
B. | CO2 | H2O | H2O |
C. | HCl | 饱和食盐水 | 水 |
D. | NO2 和O2 | H2O | H2O |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列反应属于吸热反应的是_________________________
①铝粉与氧化铁粉末反应 ②酸碱中和反应 ③硝酸铵溶于水 ④碳酸钙分解 ⑤H2在Cl2中燃烧 ⑥灼热的碳与CO2的反应 ⑦NH4Cl晶体与Ba(OH)28H2O混合搅拌
(2)在25℃、101kPa的条件下,断裂1mol H—H键吸收436 kJ能量,断裂1 mol Cl—Cl键吸收243 kJ能量,形成1mol H—Cl键放出431 kJ能量。该条件下H2+Cl2=2HCl反应中的能量变化可用如图表示:
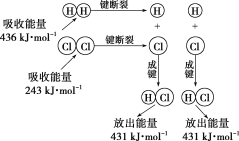
现有1 mol H2和1 mol Cl2在25℃、101 kPa下完全反应。请根据上述信息回答下列有关问题:
①该反应的热化学方程式为_____________
②反应物的总能量___________(填“>”或“<”)生成物的总能量。
(3)直接排放含SO2的烟气会形成酸雨,危害环境。工业上常采用催化还原法和碱吸收法处理SO2气体。如图所示:

1 mol CH4完全燃烧生成气态水的能量变化和1 mol S(g)燃烧的能量变化。在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式____________。
(4)几种含硅元素的物质之间的相互转化关系如图所示:
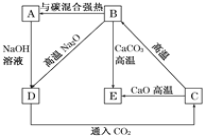
①写出下列反应的化学方程式:
B→A:_________;
B→E:_________。
②写出下列溶液中反应的离子方程式:D→C_________。
(5)Mg6Si4O10(OH)8用氧化物的形式可表示为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:常温下, ![]() 。现有1L 0.1mol·L-1的两种溶液:①NaClO溶液;② NaF溶液。下列说法正确的是
。现有1L 0.1mol·L-1的两种溶液:①NaClO溶液;② NaF溶液。下列说法正确的是
A. c(H+):①>②
B. 分别加入1L 0.1mol·L-1HCl溶液后,两溶液的pH:①<②
C. 分别加入等浓度的盐酸至溶液呈中性,消耗盐酸的体积:①<②
D. n(HF)+n(F-)=n(HClO)+n(ClO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂,可由一氧化氮与氯气在常温常压下合成。已知NOCl是一种红褐色液体或黄色气体,其熔点是-64.5℃,沸点是-5.5℃,遇水易水解。回答下列问题:
(1)实验室制备原料气NO和Cl2的装置如下图所示。

①实验室制NO时,装置A中烧瓶内发生反应的化学方程式为______________。
②实验室制Cl2时,装置B的作用是______________________。
(2)将上述收集到的Cl2充入集气瓶中,按图示装置制备亚硝酰氯。
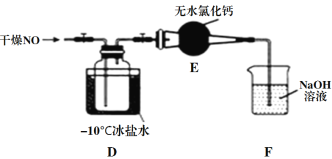
①NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_____________。
②装置D中的现象为_____________________________________________。
③装置E中无水氯化钙的作用为_______________________________。
④某同学认为装置F不能吸收NO,为解决这一问题,可将尾气与某种气体同时通入氢氧化钠溶液中,这种气体的化学式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种重要的结构陶瓷材料,属于新型功能性陶瓷产品,它的硬度大、熔点高、化学性质稳定,工业上曾普遍采用高纯硅与纯氮在1300℃时反应获得。
(1)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应。试推测该陶瓷被氢氟酸腐蚀的化学方程式:_________。
(2)现用四氧化硅和氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅及氯化氢,反应的化学方程式为____。
(3)沸石是一种含结晶水的、具有多孔结构的铝硅酸盐,化学式为Na2[Al2Si3O10(H2O)2],若以氧化物形式可表示为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年的化学诺贝尔奖颁给了为锂电池研究作出贡献的三位科学家。有两种常见锂电池:一种是采用镍钴锰酸锂Li(NiCoMn)O2或镍钴铝酸锂为正极的“三元材料锂电池”;另一种是采用磷酸铁锂为正极的磷酸铁锂电池。请回答下列问题:
(1)基态钴原子的价电子排布式为____,Mn位于元素周期表的____ 区(填“s”或“p”或“d”或“ds”或“f”)。
(2)磷元素可以形成多种含氧酸H3PO4、H3PO2、H3PO3、HPO3,这四种酸中酸性最强的是___。PO43-的空间构型是 ___,中心原子的杂化方式是 ____。
(3)CoO、MnO两种氧化物的熔点由高到低的顺序是 ___,原因是 ___。
(4)PH3是____分子(填“极性”或“非极性”),其在水中的溶解性比NH3小,原因是 _____
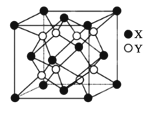
(5)硫化锂Li2S(摩尔质量Mgmol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若硫化锂晶体的密度为ag.cm-3,则距离最近的两个S2-的距离是___nm。(用含a、M、NA的计算式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com