
【题目】形形色色的物质,构成了我们这个五彩缤纷的世界。世上万物,神奇莫测,常常超乎人们按“常理"的想象。学习物质结构和性质的知识,能使你想象的翅膀变得更加有力。
(1)基态Ga原子的核外电子排布式是[Ar]__,基态Ga原子核外电子占据最高能级的电子云轮廓图为___。
(2)HC≡CNa(乙炔钠)广泛用于有机合成,乙炔钠中C原子的杂化类型为___。乙炔钠中存在___(填字母)。
A.金属键 B.σ键 C.π键 D.氢键 E.配位键 F.离子键 G.范德华力
(3)NaN3是汽车安全气囊中的主要化学成分,其阴离子的立体构型为____。写出和该阴离子互为等电子体的一种分子的结构式___。
(4)钙和铁都是第四周期元素,且原子的最外层电子数相同,铁的熔沸点远高于钙,其原因是____。
(5)配体中配位原子提供孤电子对的能力与元素的电负性有关,SCN-的结构式可以表示为[S=C=N]-或[S-C≡N]-,SCN-与Fe3+、Au+和Hg2+等离子能形成配离子,N、C、S的电负性依次为3.0、2.5和2.5。SCN-中提供孤电子对的原子可能是___。
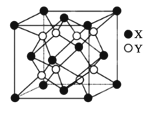
(6)某离子晶体的晶胞结构如图所示。
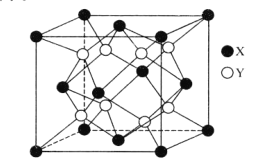
①晶体中在每个X周围与它最近且距离相等的X共有___个。
②设该晶体的摩尔质量为Mg·mol-1,晶胞的密度为ρg.cm-3,阿伏加德罗常数为NA,则晶体中两个最近的X间的距离为___cm。
【答案】3d104s24p1 哑铃形 sp BCF 直线形 ![]() 钙原子半径较大且价电子数少,金属键较弱 S 12
钙原子半径较大且价电子数少,金属键较弱 S 12 ![]()
【解析】
(1)Ga原子位于第4周期IIIA族,为31号,则基态Ga原子的核外电子排布式为:[Ar]3d104s24p1,核外电子占据最高的能级为4p能级,p能级的电子云形状为哑铃形;
(2)碳原子之间形成碳碳三键,空间构型为直线型,杂化方式为sp杂化;碳碳三键中有两个π键和一个σ键,Na+与C2H-之间为离子键,所以选BCF;
(3)NaN3的阴离子为N3-,中心N原子的价层电子对数为![]() ,无孤电子对,所以杂化方式为sp杂化,空间构型为直线形;具有相同价电子数和相同原子数的分子或离子称为等电子体,N3-的价电子数为5×3+1=16,所以与N3-互为等电子的分子可以是CO2或N2O,其结构式为:
,无孤电子对,所以杂化方式为sp杂化,空间构型为直线形;具有相同价电子数和相同原子数的分子或离子称为等电子体,N3-的价电子数为5×3+1=16,所以与N3-互为等电子的分子可以是CO2或N2O,其结构式为:![]() ;
;
(4)金属晶体的熔沸点与金属键强弱有关,钙原子半径较大且价电子数少,金属键较弱,所以铁的熔沸点远高于钙;
(5)C没有孤对电子,S、N原子均有孤对电子,N的电负性大对孤对电子吸引越强,不易给出电子形成配位键,所以提供孤电子对的是S原子;
(6)①以顶点上的X为例,与它距离最近的X分布在与之相连的面心上,这样的原子有12个;
②根据均摊法可知因为晶体的晶胞中含有4个X和8个Y,根据晶胞密度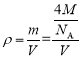 可得晶胞的体积为
可得晶胞的体积为![]() ,进而可以求得晶胞的边长为
,进而可以求得晶胞的边长为![]() ,因为两个距离最近的X的核间距离为晶胞面对角线的一半,所以晶体中两个距离最近的X的核间距离为
,因为两个距离最近的X的核间距离为晶胞面对角线的一半,所以晶体中两个距离最近的X的核间距离为 ![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】多硫化钠Na2Sx(x≥2)在结构上与Na2O2、FeS2等有相似之处,Na2Sx在碱性溶液中可被NaClO氧化成Na2SO4,而NaClO被还原成NaCl,反应中Na2Sx与NaClO的物质的量之比为1:16,则x值是( )
A.5B.4C.3D.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂,可由一氧化氮与氯气在常温常压下合成。已知NOCl是一种红褐色液体或黄色气体,其熔点是-64.5℃,沸点是-5.5℃,遇水易水解。回答下列问题:
(1)实验室制备原料气NO和Cl2的装置如下图所示。

①实验室制NO时,装置A中烧瓶内发生反应的化学方程式为______________。
②实验室制Cl2时,装置B的作用是______________________。
(2)将上述收集到的Cl2充入集气瓶中,按图示装置制备亚硝酰氯。
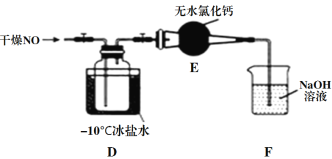
①NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_____________。
②装置D中的现象为_____________________________________________。
③装置E中无水氯化钙的作用为_______________________________。
④某同学认为装置F不能吸收NO,为解决这一问题,可将尾气与某种气体同时通入氢氧化钠溶液中,这种气体的化学式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种重要的结构陶瓷材料,属于新型功能性陶瓷产品,它的硬度大、熔点高、化学性质稳定,工业上曾普遍采用高纯硅与纯氮在1300℃时反应获得。
(1)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应。试推测该陶瓷被氢氟酸腐蚀的化学方程式:_________。
(2)现用四氧化硅和氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅及氯化氢,反应的化学方程式为____。
(3)沸石是一种含结晶水的、具有多孔结构的铝硅酸盐,化学式为Na2[Al2Si3O10(H2O)2],若以氧化物形式可表示为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质结构、性质的说法中正确的是( )

①烃的密度比水的密度小
②C2H6、C4H10、C6H14在常温下均为气体
③1 mol苯最多与3 mol H2发生加成反应,是因为苯分子含有3个碳碳双键
④水芹烯(桂皮中的一种成分)键线式如图,其分子式为C10H16
⑤![]() 互为同系物
互为同系物
⑥甲烷与氯气在光照的条件下可以制取纯净的一氯甲烷
⑦C5H12有三种同分异构体
A. ①②⑤ B. ③④⑦ C. ③⑤⑥ D. ①④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国盛产山茶籽精油,其主要成分柠檬醛可以合成具有工业价值的β—紫罗兰酮。

(1)要检验柠檬醛中含有碳碳双键,需要使用下列试剂中的________(按反应顺序填试剂序号)。
A.氢氧化钠溶液 B.酸性高锰酸钾溶液
C.银氨溶液 D.碳酸钠溶液
(2)写出柠檬醛和新制氢氧化铜反应的化学方程式__________ 。
(3)柠檬醛有多种同分异构体,能满足下列条件的同分异构体有________ 种。
A.含有一个![]() 的六元环结构,六元环上只有一个取代基
的六元环结构,六元环上只有一个取代基
B.能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M(如图所示)可用于制备各种高性能防腐蚀涂料。W、X、Y、Z是原子序数依次增大的短周期主族元素,且占据三个不同周期,W与Z的质子数之和是X的2倍。下列说法不正确的是
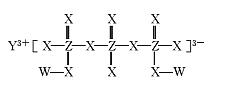
A.原子半径:Y>Z>X
B.X元素的族序数是Y元素的2倍
C.工业上电解熔融Y2X3化合物制备单质Y
D.W与X形成的所有化合物都只含极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年的化学诺贝尔奖颁给了为锂电池研究作出贡献的三位科学家。有两种常见锂电池:一种是采用镍钴锰酸锂Li(NiCoMn)O2或镍钴铝酸锂为正极的“三元材料锂电池”;另一种是采用磷酸铁锂为正极的磷酸铁锂电池。请回答下列问题:
(1)基态钴原子的价电子排布式为____,Mn位于元素周期表的____ 区(填“s”或“p”或“d”或“ds”或“f”)。
(2)磷元素可以形成多种含氧酸H3PO4、H3PO2、H3PO3、HPO3,这四种酸中酸性最强的是___。PO43-的空间构型是 ___,中心原子的杂化方式是 ____。
(3)CoO、MnO两种氧化物的熔点由高到低的顺序是 ___,原因是 ___。
(4)PH3是____分子(填“极性”或“非极性”),其在水中的溶解性比NH3小,原因是 _____
(5)硫化锂Li2S(摩尔质量Mgmol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若硫化锂晶体的密度为ag.cm-3,则距离最近的两个S2-的距离是___nm。(用含a、M、NA的计算式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】很多化学反应在4K高清摄影机下美轮美奂。下列反应属于氧化还原反应的是
A.  Al片投入AgNO3溶液中
Al片投入AgNO3溶液中
B.  Zn片投入CuSO4溶液中
Zn片投入CuSO4溶液中
C.  AgNO3溶液滴入NaCl溶液中
AgNO3溶液滴入NaCl溶液中
D.  Mg条投入盐酸中
Mg条投入盐酸中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com