
【题目】盛有10mLNO2和O2的混合气体的量筒倒立于水槽中,充分反应后还剩余4mL无色气体,则剩余气体可能为( )
A.NO和O2B.NO或O2C.NOD.O2
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】溴乙烷在不同溶剂中与NaOH反应生成不同的产物,同学们据此展开探究。
(实验1)甲同学利用如图所示装置进行实验:
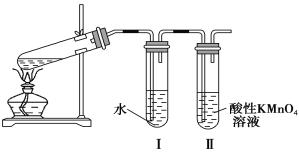
(1)甲同学的实验目的为____________________________。
(2)实验过程中可观察到试管Ⅱ中的现象为__________________________________________________。
(3)试管Ⅰ的作用为_________________________________________________________。
(实验2)乙同学在试管中加入3 mL溴乙烷和3 mL NaOH溶液,振荡,加热。
(4)此反应的化学方程式为_________________________________________。
(5)停止加热并冷却后,欲证明确实发生了上述反应,还应进行的操作为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸是重要的化学试剂和工业原料。请回答下列问题:
(1)已知:25℃时,磷酸和氢氟酸的电离常数如下表所示。
物质 | H3PO4 | HF |
电离常数 | Ka1=7.1×103; Ka2=6.3×108; Ka3=4.2×1013 | Ka=6.6×104 |
向NaF溶液中滴加少量H3PO4溶液,反应的离子方程式为____________
(2)已知:
Ⅰ.CaO(s)+H2SO4(l)![]() CaSO4(s)+H2O(l) ΔH=-271kJ·mol1
CaSO4(s)+H2O(l) ΔH=-271kJ·mol1
Ⅱ.5CaO(s)+3H3PO4(l)+HF(g)![]() Ca5(PO4)3F(s)+5H2O(l) ΔH=-937kJ·mol1
Ca5(PO4)3F(s)+5H2O(l) ΔH=-937kJ·mol1
则:①工业上用Ca5(PO4)3F和硫酸反应制备磷酸的热化学方程式为____________。
②一定条件下,在密闭容器中只发生反应Ⅱ,达到平衡后缩小容器容积,HF的平衡转化率________(填“增大”“减小”或“不变”,下同);HF的平衡浓度________。
(3)工业上用磷尾矿制备Ca5(PO4)3F时生成的副产物CO可用于制备H2,原理为CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH。
CO2(g)+H2(g) ΔH。
①一定温度下,向10L密闭容器中充入0.5mol CO和1mol H2O(g),2min达到平衡时,测得0~2min内用CO2表示的反应速率v(CO2)=0.02mol·L1·min1。则CO的平衡转化率α=________;该反应的平衡常数K=________。
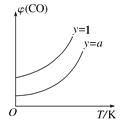
②在压强不变的密闭容器中发生上述反应,设起始的![]() =y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的ΔH___0(填“>”“<”或“=”,下同)。a_____1,理由为_____________
=y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的ΔH___0(填“>”“<”或“=”,下同)。a_____1,理由为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对大量盆栽鲜花施用了S﹣诱抗素制剂,以保持鲜花盛开,S﹣诱抗素的分子结构如图,下列关于该分子的说法中正确的是( )
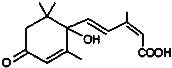
A. 含有碳碳双键、羟基、醛基、羧基
B. 能发生加成反应、氧化反应、取代反应、缩聚反应
C. 1mol该分子能与含2mol NaOH的溶液完全反应
D. 该分子能与溴水反应而使溴水褪色且1mol它能与溴水中的4mol Br2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多硫化钠Na2Sx(x≥2)在结构上与Na2O2、FeS2等有相似之处,Na2Sx在碱性溶液中可被NaClO氧化成Na2SO4,而NaClO被还原成NaCl,反应中Na2Sx与NaClO的物质的量之比为1:16,则x值是( )
A.5B.4C.3D.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氯酸是一种强酸,氯酸的浓度超过40%就会迅速分解,生成有毒气体,反应的化学方程式为8HClO3=3O2↑+2Cl2↑+4HClO4+2H2O。所得混合气体的平均相对分子质量为________。
(2)实验室可用软锰矿(主要成分为MnO2)制取KMnO4,方法如下:高温下使软锰矿与过量KOH(s)和KClO3 (s)反应,生成K2MnO4(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,K2MnO4转化为MnO2和KMnO4;再滤去沉淀MnO2,浓缩结晶得到KMnO4晶体。K2MnO4转化为KMnO4的反应中氧化剂和还原剂的物质的量之比为________。
(3)已知测定锰的一种方法是:锰离子转化为高锰酸根离子,反应体系中有H+、Mn2+、H2O、![]() 、
、![]() 、
、![]() 。
。
①该反应的离子方程式为________________________。在锰离子转化为高锰酸根离子的反应中,如果把反应后的溶液稀释到1 L,测得溶液的pH=2,则在反应中转移电子的物质的量为________ mol。(结果写成小数,保留三位有效数字)
②在测定锰离子浓度的实验中,需要配制250 mL 0.10mol/L KIO4的标准溶液,应用托盘天平称取 ______g KIO4固体。
③下列有关配制溶液的操作或判断正确的是(_________)
A.使用容量瓶前必须检查容量瓶是否完好以及瓶塞处是否漏水
B.容量瓶用蒸馏水洗净后,没有烘干就用来配制溶液
C.定容摇匀后液面下降再加水到刻度线,不影响所配溶液浓度
D.定容时仰视刻度线会导致所配溶液浓度偏高
E.当容量瓶中的液面距离刻度线2~3cm时改用胶头滴管加水定容
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用下图进行喷泉实验,已知圆底烧瓶内充满X气体,胶头滴管内装有少量Y液体,烧杯内装有足量Z液体,下列组合能进行喷泉实验且最终液体一定能充满整个烧瓶的是( )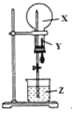
X气体 | Y试剂 | Z试剂 | |
A. | NO2 | H2O | H2O |
B. | CO2 | H2O | H2O |
C. | HCl | 饱和食盐水 | 水 |
D. | NO2 和O2 | H2O | H2O |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:常温下, ![]() 。现有1L 0.1mol·L-1的两种溶液:①NaClO溶液;② NaF溶液。下列说法正确的是
。现有1L 0.1mol·L-1的两种溶液:①NaClO溶液;② NaF溶液。下列说法正确的是
A. c(H+):①>②
B. 分别加入1L 0.1mol·L-1HCl溶液后,两溶液的pH:①<②
C. 分别加入等浓度的盐酸至溶液呈中性,消耗盐酸的体积:①<②
D. n(HF)+n(F-)=n(HClO)+n(ClO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国盛产山茶籽精油,其主要成分柠檬醛可以合成具有工业价值的β—紫罗兰酮。

(1)要检验柠檬醛中含有碳碳双键,需要使用下列试剂中的________(按反应顺序填试剂序号)。
A.氢氧化钠溶液 B.酸性高锰酸钾溶液
C.银氨溶液 D.碳酸钠溶液
(2)写出柠檬醛和新制氢氧化铜反应的化学方程式__________ 。
(3)柠檬醛有多种同分异构体,能满足下列条件的同分异构体有________ 种。
A.含有一个![]() 的六元环结构,六元环上只有一个取代基
的六元环结构,六元环上只有一个取代基
B.能发生银镜反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com