
【题目】下列叙述正确的是( )
A.分散质粒子的直径在1~100 nm之间的微粒称为胶体
B.电泳现象可证明胶体属于电解质溶液
C.利用丁达尔效应可以区别溶液与胶体
D.Fe(OH)3胶体带正电荷,可以产生电泳现象
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】Na3N是科学家制备的新化合物,它可以和水反应生成两种碱性物质,其中一种A可以发生下列转化关系(A、B、C、D为中学常见物质且均含有同一种元素,反应条件及其他物质已经略去):
A![]() B
B![]() C
C![]() D
D
(1)Na3N中N的化合价为_______;
(2)写出Na3N和水反应的化学方程式_______;
(3)写出C→D的离子方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Z是非金属元素,W、X的最高价氧化物对应的水化物可以相互反应生成盐和水,向一定量的W的最高价氧化物对应的水化物溶液中逐滴加入XZ3溶液,生成的沉淀X(OH)3的质量随XZ3溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是()

A. d点对应的溶液中:K+、NH4+、CO32﹣、I﹣
B. c点对应的溶液中:Ag+、Ca2+、NO3﹣、Na+
C. b点对应的溶液中:Na+、S2﹣、SO42﹣、Cl﹣
D. a点对应的溶液中:Na+、K+、SO42﹣、HCO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家冶炼出了纯度高达99.9999%的铁,根据你的推测,下列性质它不可能具有的是
A.硬度比生铁低 B.在潮湿的空气中放置不易生锈
C.在冷的浓硫酸中可以钝化 D.与4mol/L盐酸反应的速率比生铁快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用MnO2和浓盐酸在加热条件下反应制取Cl2。下列说法正确的是
A. 反应中HCl既表现酸性,又表现还原性
B. 用饱和碳酸氢钠溶液可除去Cl2中的HCl
C. 用NaOH溶液吸收Cl2,反应中Cl2只作氧化剂
D. 将湿润的有色布条伸入集满Cl2的集气瓶中,布条褪色说明Cl2具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫的催化氧化原理为![]() ,反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是( )
,反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是( )
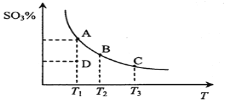
A.在D点时v正<v逆
B.反应2SO2(g)+O2(g) ![]() 2SO3(g) △H<0
2SO3(g) △H<0
C.若B、C点的平衡常数分别为KB、KC,则KB> KC
D.恒温恒压下向平衡体系中通入氦气,平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年诺贝尔化学奖获得者是三位在“分子机器(蛋白质是其主要构件之一)”设计与合成领域作出巨大贡献的科学家。下列不属于蛋白质的重要组成元素是:
A. C B. N C. O D. Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在体积为2 L的密闭容器中混合,并在一定条件下发生反应:2A(g)+B(g) ![]() xC(g),若经2 s后测得A的物质的量为2.8 mol,C的物质的量浓度为0.6 mol/L。现有下列几种说法:
xC(g),若经2 s后测得A的物质的量为2.8 mol,C的物质的量浓度为0.6 mol/L。现有下列几种说法:
①2 s内用物质A表示的平均反应速率为0.3 mol/(L·s);
②2 s内用物质B表示的平均反应速率为0.15 mol/(L·min)
③2 s时物质B的转化率为70%;
④x=2。
其中正确的是:
A. ①④ B. ②③ C. ①②③ D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为2 MnO4-+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:

实验序号 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1 H2C2O4溶液 | 30 mL 0.01 mol·L-1 KMnO4溶液 |
② | 20 mL 0.2 mol·L-1 H2C2O4溶液 | 30 mL 0.01 mol·L-1 KMnO4溶液 |
(1)该实验探究的是_________________________________因素对化学反应速率的影响。
(2)若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min末,c(MnO4-)=________ mol·L-1(假设混合溶液的体积为50 mL)。
(3)小组同学发现反应速率变化如图乙,其中t1~t2时间内速率变快的主要原因可能是:
①产物Mn2+是反应的催化剂,②_______________________________
Ⅱ:当温度高于500 K时,科学家成功利用二氧化碳和氢气合成了乙醇,这在节能减排、降低碳排放方面具有重大意义。回答下列问题:
(1)该反应的化学方程式为___________________________________
(2)在恒温恒容密闭容器中,判断上述反应达到平衡状态的依据是________________
a.体系压强不再改变 b.H2的浓度不再改变
c.气体的密度不随时间改变 d.单位时间内消耗H2和CO2的物质的量之比为3∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com