
【题目】Ⅰ:用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为2 MnO4-+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:

实验序号 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1 H2C2O4溶液 | 30 mL 0.01 mol·L-1 KMnO4溶液 |
② | 20 mL 0.2 mol·L-1 H2C2O4溶液 | 30 mL 0.01 mol·L-1 KMnO4溶液 |
(1)该实验探究的是_________________________________因素对化学反应速率的影响。
(2)若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min末,c(MnO4-)=________ mol·L-1(假设混合溶液的体积为50 mL)。
(3)小组同学发现反应速率变化如图乙,其中t1~t2时间内速率变快的主要原因可能是:
①产物Mn2+是反应的催化剂,②_______________________________
Ⅱ:当温度高于500 K时,科学家成功利用二氧化碳和氢气合成了乙醇,这在节能减排、降低碳排放方面具有重大意义。回答下列问题:
(1)该反应的化学方程式为___________________________________
(2)在恒温恒容密闭容器中,判断上述反应达到平衡状态的依据是________________
a.体系压强不再改变 b.H2的浓度不再改变
c.气体的密度不随时间改变 d.单位时间内消耗H2和CO2的物质的量之比为3∶1
【答案】浓度0.0052反应放热,温度升高2CO2+6H2![]() C2H5OH(g)+3H2O(g)ab
C2H5OH(g)+3H2O(g)ab
【解析】
Ⅰ:(1)对比①②实验可知,探究的是浓度对化学反应速率的影响,故答案为:浓度;
(2)CO2的物质的量是:4.48mL×10-322.4mol/l=0.0002mol,设2min末,反应的MnO4-的物质的量为X,
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
2 10
X 0.0002mol
解得 X=0.00004mol,30mL×10-3×0.01molL-1-0.00004mol=0.00026mol,c(MnO4-)=nv=0.00026mol0.05L=0.0052mol/L,故答案为:0.0052;
(3)影响化学反应速率的因素主要有温度、浓度、压强和催化剂,除催化剂之外,只能是温度升高导致反应速率加快,故答案为:该反应放热使反应温度升高;
Ⅱ:(1)当温度高于500K时,科学家成功利用二氧化碳和氢气合成了1mol乙醇和水,该反应的化学方程式为:2CO2+6H2CH3CH2OH(g)+3H2O(g),故答案为:2CO2+6H2CH3CH2OH(g)+3H2O(g);
(2)a.该反应中混合气体的物质的量减小,则体系压强一直在减小,当体系压强不再改变,能说明到达平衡,故a正确;b.H2的浓度不再改变,说明正逆反应速率相等,该反应达到平衡状态,故b正确;c.容器的体积不变,混合气体的质量不变,混合气体的密度始终不变,气体的密度不随时间改变,不能说明到达平衡,故c错误;d.单位时间内消耗H2和CO2的物质的量之比为3:1,指正反应方向,无法判断正逆反应速率是否相等,则不能说明到达平衡,故d错误;故答案为:ab。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.分散质粒子的直径在1~100 nm之间的微粒称为胶体
B.电泳现象可证明胶体属于电解质溶液
C.利用丁达尔效应可以区别溶液与胶体
D.Fe(OH)3胶体带正电荷,可以产生电泳现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在298 K时,实验测得溶液中的反应:H2O2+2HI===2H2O+I2,在不同浓度时的化学反应速率见下表,由此可推知当c(HI)=0.500 mol·L-1,c(H2O2)=0.400 mol·L-1时的反应速率为( )
实验编号 | 1 | 2 | 3 | 4 | 5 |
c(HI)/mol·L-1 | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
c(H2O2)/mol·L-1 | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
v/mol·L-1·s-1 | 0.007 60 | 0.015 3 | 0.022 7 | 0.015 1 | 0.022 8 |
A. 0.152 mol·L-1·s-1 B. 0.038 0 mol·L-1·s-1
C. 0.608 mol·L-1·s-1 D. 0.760 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着各地“限牌”政策的推出,电动汽车成为汽车界的“新宠”。特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图所示。其中 A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导 Li+的高分子材料,隔膜只允特定的离子通过,电池反应式为:LixC6+Li1-xCoO2![]() C6+LiCoO2。下列说法不正确的是( )
C6+LiCoO2。下列说法不正确的是( )

A. 该隔膜只允许 Li+通过,放电时 Li+从左边流向右边
B. 放电时,正极锂的化合价未发生改变
C. 充电时 B 作阳极,该电极放电时的电极反应式为 Li1-xCoO2+xLi++xe-=LiCoO2
D. 废旧钴酸锂(LiCoO2)电池进行“放电处理”让 Li+进入石墨中而有利于回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别燃烧等物质的量的下列各组物质,其中消耗氧气的量相等的是( )
①C2H2与C2H4O ②C4H8与C6H12O6 ③C7H8与C6H12 ④HCOOCH3与CH3COOH.
A.①③④ B.①②③④ C.①④ D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. ![]() 在核磁共振氢谱中有5个吸收峰
在核磁共振氢谱中有5个吸收峰
B. 红外光谱图只能确定有机物中所含官能团的种类和数目
C. 质谱法不能用于相对分子质量的测定
D. 核磁共振氢谱、红外光谱和质谱都可用于分析有机物结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤干馏可获得重要的化工原料,应用非常广泛。将煤焦油中的苯、甲苯与苯酚进行分离,可采取:
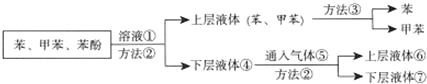
(Ⅰ)①和⑤的化学式:①_______、⑤_______。
(Ⅱ)分离方法:②_______、③_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
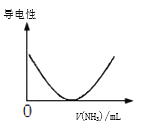
【题目】下列说法不正确的是
A.在常温下SiO2(s)+2C(s)=Si(s)+2CO(g)不能自发进行,则该反应的H>0
B.常温下,NH4Cl溶液加水稀释,![]() 不变
不变
C.向硅酸钠溶液中滴加酚酞,溶液变红,证明Na2SiO3发生了水解
D.如图可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com