
| A. | ①②③④⑤⑥ | B. | ①③④⑤ | C. | ④⑤ | D. | ①④⑤⑥ |
分析 常见的既能与酸反应又能与碱反应的物质主要有:①两性物质:Al2O3、ZnO、Al(OH)3、Zn(OH)2、氨基酸、蛋白质等;②多元弱酸的酸式盐:NaHCO3、KHS、KHSO3、NaH2PO4等;③弱酸的铵盐及其酸式盐:(NH4)2S、NH4HS、(NH4)2CO3、NH4HCO3、CH3COONH4等;④某些具有两性的金属:Zn、Al等,据此解答.
解答 解:①Al与盐酸反应生成氯化铝和氢气,与氢氧化钠反应生成偏铝酸钠和氢气,故选;
②AlCl3 与强酸不反应,故不选;
③Na AlO2 与氢氧化钠不反应,故不选;
④Al(OH)3 属于两性氢氧化物,与盐酸和氢氧化钠反应都生成盐和水,故选;
⑤Al2O3 属于两性氧化物,与盐酸和氢氧化钠反应都生成盐和水,故选;
⑥NaHCO3与盐酸反应生成氯化钠和水、二氧化碳,与氢氧化钠反应生成碳酸钠和水,故选;
故选:D.
点评 本题考查元素化合物性质,题目难度不大,注意基础知识的积累,注意具有两性和能与酸、碱反应的区别.


科目:高中化学 来源: 题型:选择题
| A. | CuO做氧化剂 | B. | Cu做还原剂 | ||
| C. | 铜是氧化产物 | D. | 铜元素化合剂升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 第一电离能 | 键能 | 沸点 | 离子半径 |
| Be>B | C-C>Si-Si | H2S<H2O | Al3+<O2- |
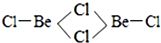
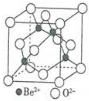
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Mg、Al | B. | Mg、Fe | C. | Zn、Fe | D. | Al、Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
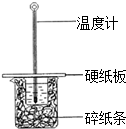 某学生实验小组用50mL0.50mol•L-1的盐酸与50mL0.50mol•L-1的NaOH溶液在如图所示的装置中进行中和反应反应热的测定
某学生实验小组用50mL0.50mol•L-1的盐酸与50mL0.50mol•L-1的NaOH溶液在如图所示的装置中进行中和反应反应热的测定查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
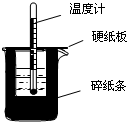 50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com