
| 4-2×2 |
| 2 |
| 6-1×2 |
| 2 |


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
 氧元素与多种元素具有亲和力,所形成化合物的种类仅次于碳元素.
氧元素与多种元素具有亲和力,所形成化合物的种类仅次于碳元素.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ④ | ⑥ | ⑦ | |||||
| 3 | ① | ② | ③ | ⑤ | ⑧ | ⑨ | ⑩ | |
| 4 | ? |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氘原子中的质子和中子 |
| B、C2H4分子中的质子和电子 |
| C、Na2O2固体中的阴离子和阳离子 |
| D、常温下,pH=7的CH3COOH与CH3COONa混合溶液中的H+与OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HN3只是氧化产物,且分子中存在极性键和非极性键 |
| B、联氨常温下为液态,是因为N2H4分子间存在氢键 |
| C、每生成2mol H2O,反应中转移电子的物质的量一定为4mol |
| D、联氨(N2H4)分子中σ键和π键个数比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、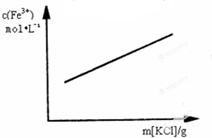 FeCl3+3KSCN?Fe(SCN)3+KCl(忽略液体体积变化) | ||
B、 2NO+O2?2NO2△H<0 | ||
C、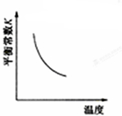 NO(g)+CO(g)?
| ||
D、 A2(g)+3B2(g)?2AB3(g)△H=-373.4KJ?mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com