
【题目】氰气的分子式为(CN)2,结构式为N![]() C-C
C-C![]() N,性质与卤素相似,下列叙述正确的是
N,性质与卤素相似,下列叙述正确的是
A. 分子中四原子共直线,是非极性分子 B. N![]() C 键的键长大于C
C 键的键长大于C![]() C键的键长
C键的键长
C. 分子中含有2个σ键和4个π键 D. 氰气不和氢氧化钠溶液发生反应
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A. 分子式为C8H8O2的芳香族化合物中属于羧酸的同分异构体有3种
B. 麦芽糖的水解产物有两种,且互为同分异构体
C. 等质量的苯和苯乙烯(![]() )完全燃烧,消耗氧气的体积相同
)完全燃烧,消耗氧气的体积相同
D. 分子式为C4H8Cl2且含有两个甲基的有机物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是( )
A. 化学电池是将化学能转变成电能的装置
B. 化学电池的种类包括一次电池、二次电池和燃料电池等
C. 化学电池供能稳定可靠,可以制成各种形状和大小,使用方便,易于维护
D. 废旧电池可以随意丢弃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol H2燃烧生成液态水时放出285.8kJ 热量,下列表示该反应的热化学方程式正确的是
A. 2H2(g)+O2(g)=2H2O(l) △H =-142.9kJ/mol
B. 2H2(g)+O2(g)=2H2O(l) △H =+571.6 kJ/mol
C. 2H2(g)+O2(g)=2H2O(l) △H =-57l.6 kJ/mol
D. 2H2+O2=2H2O △H =-571.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p 轨道上有4个电子。元素Z 的原子最外层电子数是其内层的3倍。

(1)X与Y所形成化合物晶体的晶胞如右图所示。
①在1个晶胞中,X离子的数目为 。
②该化合物的化学式为 。
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是 。
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是 。
(4)Y 与Z 可形成YZ42-
①YZ42-的空间构型为 。
②写出一种与YZ42-互为等电子体的分子的化学式: 。
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸四氨合铜(Ⅱ)是一种重要的染料及农药中间体。a、b、c、d、e是硫酸四氨合铜(Ⅱ)中原子序数依次增大的五种元素。
(1)该配合物中,配体的电子式为________;五种元素中电负性最大的是________ (填元素名称),基态b原子的价层电子排布图为______________________。
(2)a和其它4种元素形成的二元共价化合物中,分子中既含有极性共价键、又含有非极性共价键的化合物是_______________、______________(填化学式,写出两种)。
(3)基态e原子中,核外占据最高能层的电子的电子云轮廓图形状为________形;c、d元素形成的分子dc3中心原子杂化轨道类型为________。
(4)元素d可以形成两种常见含氧酸,其通式为(HO)mdOn,请根据结构与性质的关系解释该两种含氧酸酸性强弱的原因是_____________________________。
(5)与铜同周期的锌为六方最密堆积晶体,晶胞如图。锌的原子半径为r,在正四面体A1A2A4B中,点A1到A2A4B平面的距离为h,NA是阿伏加德罗常数的值。锌原子的配位数为________,晶胞参数(长、宽、高)依次为________,晶体密度的计算式为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
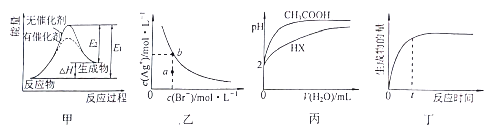
A. 图甲表示放热反应在有无催化剂的情况下反应过程中的能量变化
B. 图乙表示一定温度下,溴化银在水中的沉淀溶解平衡曲线,其中a点代表的是不饱和溶液,b点代表的是饱和溶液
C. 图丙表示25℃时,分别加水稀释体积均为100mL、pH=2的一元酸CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数大于CH3COOH
D. 图丁表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有化学纯的浓硫酸,其试剂瓶标签上的部分内容如下图:

请回答下列问题:
(1)配制溶液时,一般可以分为以下几个主要步骤:
①量取 ②计算 ③溶解 ④定容 ⑤转移 ⑥洗涤 ⑦装瓶,其正确的操作顺序为___________(填序号)。
(2)实验室只有100mL、250mL、500mL三种规格的容量瓶,但要配制480 mL 0.50 mol/L的稀硫酸,需取该浓硫酸______mL。
(3)接下来完成此实验你将用到的仪器有20mL量筒、烧杯、玻璃棒、____________。
(4)要从所配溶液中取出50 mL盛装于试剂瓶中,给它贴上标签,则标签的内容是________________;若再从中取出10 mL溶液稀释至20 mL,则稀释后溶液的物质的量浓度为__________。
(5)下列操作会使所配溶液浓度偏低的是__________。
A. 用量筒量取浓硫酸,读数时仰视刻度线 B. 转移溶液时未洗涤烧杯
C. 容量瓶用蒸馏水洗净后仍残留有蒸馏水 D. 定容时俯视容量瓶的刻度线
E. 定容摇匀后,发现液面低于刻度线,再加水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com