
【题目】硫酸四氨合铜(Ⅱ)是一种重要的染料及农药中间体。a、b、c、d、e是硫酸四氨合铜(Ⅱ)中原子序数依次增大的五种元素。
(1)该配合物中,配体的电子式为________;五种元素中电负性最大的是________ (填元素名称),基态b原子的价层电子排布图为______________________。
(2)a和其它4种元素形成的二元共价化合物中,分子中既含有极性共价键、又含有非极性共价键的化合物是_______________、______________(填化学式,写出两种)。
(3)基态e原子中,核外占据最高能层的电子的电子云轮廓图形状为________形;c、d元素形成的分子dc3中心原子杂化轨道类型为________。
(4)元素d可以形成两种常见含氧酸,其通式为(HO)mdOn,请根据结构与性质的关系解释该两种含氧酸酸性强弱的原因是_____________________________。
(5)与铜同周期的锌为六方最密堆积晶体,晶胞如图。锌的原子半径为r,在正四面体A1A2A4B中,点A1到A2A4B平面的距离为h,NA是阿伏加德罗常数的值。锌原子的配位数为________,晶胞参数(长、宽、高)依次为________,晶体密度的计算式为__________。

【答案】 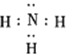 氧
氧 ![]() H2O2 N2H4 球 sp2 由通式可知,H2SO4的n值大于H2SO3,S的正电性越高,导致S-O-H中O的电子向S偏移程度大,因而更易电离出H+,酸性更强 12 2r、2r、2h 65×2/(8hr2NASin60°)(或65×2/4
H2O2 N2H4 球 sp2 由通式可知,H2SO4的n值大于H2SO3,S的正电性越高,导致S-O-H中O的电子向S偏移程度大,因而更易电离出H+,酸性更强 12 2r、2r、2h 65×2/(8hr2NASin60°)(或65×2/4![]() hr2NA)(或
hr2NA)(或![]() )
)
【解析】(1)已知硫酸四氨合铜(Ⅱ)的化学式为Cu(NH3)4SO4,所以原子序数依次增大的五种元素a、b、c、d、e分别是H、N、O、S、Cu,其中的配体为NH3,其电子式为![]() ;根据电负性变化规律,一般地同周期从左到右逐渐增大,同主族从上到下逐渐减小,所以这五种元素中电负性最大的是氧元素;基态N原子的价层电子排布图为
;根据电负性变化规律,一般地同周期从左到右逐渐增大,同主族从上到下逐渐减小,所以这五种元素中电负性最大的是氧元素;基态N原子的价层电子排布图为![]() 。
。
(2)H与其它4种元素形成的二元共价化合物有NH3、N2H4、H2O、H2O2、H2S等,其中既含有极性共价键、又含有非极性共价键的化合物是H2O2、N2H4。
(3)基态Cu原子的价电子排布式为3d104s1,核外占据最高能层为4s,其电子云形状为球形;O、S两元素形成的分子SO3中,S原子的杂化轨道类型为sp2,即![]() (6+0)=3,需要形成三个杂化轨道,所以是sp2杂化。
(6+0)=3,需要形成三个杂化轨道,所以是sp2杂化。
(4)S元素可以形成两种常见含氧酸,其通式为(HO)mSOn,即亚硫酸为(HO)2SO,硫酸为(HO)2SO2,也就是说H2SO4的n值大于H2SO3的n值,使S原子的正电性增大,导致S-O-H中电子向S偏移程度增大,因而更易电离出H+,故硫酸的酸性更强。
(5)已知该晶体为六方最密堆积,所以其配位数为12;设锌的原子半径为r cm,点A1到A2A4B平面的距离为hcm,则该晶胞的参数为长为2r cm、宽为2r cm,高为正四面体高的2倍即2h cm;该晶胞中含有2个Zn原子,其质量为65×2/NA g,体积为8hr2Sin60°cm3,所以晶体的密度为65×2/(8hr2NASin60°)g/cm3(或65×2/4![]() hr2NA g/cm3)(或
hr2NA g/cm3)(或![]() g/cm3)
g/cm3)


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案科目:高中化学 来源: 题型:
【题目】由一种短周期金属元素和一种非金属元素组成的化合物X可与水发生复分解反应。某校兴趣小组用如图装置(夹持装置略去)对其进行探究实验。
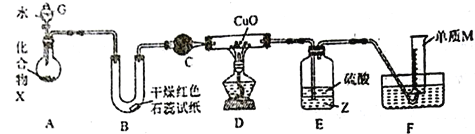
(1)仪器G的名称是_____________________,B中红色石蕊试纸变蓝,则单质M的电子式为___________________。
(2)化合物X中含组成单质M的元素质量分数为16.9%,写出X与水反应的化学方程式:_____________________________。
(3)C中的试剂名称为___________________________。
(4)实验时,装置D中硬质玻璃管内的现象为_________________________。
(5)裝置E中试剂Z为___________(填化学式),装置E的作用是_________________________。
(6)若不通过E、F两装置,请设计实验方案证明D中发生了反应(不通过观察D中固体颜色发生变化):__________________________________________________。
(7)若装置A中固体样品含有杂质(杂质不参与反应),某同学通过测定F中单质M在标准状况下的体积和固体样品的质量,以确定固体样品中X的质量分数,判断该方案是否可行,并说明原因:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据权威刊物报道,1996年科学家在宇宙中发现H3分子。甲、乙、丙、丁四位学生对此报道的认识正确的是
A.甲认为上述发现绝对不可能,因为H3分子违背了共价键理论
B.乙认为宇宙中还可能存在另一种氢单质,因为氢元素有三种同位素必然有三种同素异形体
C.丙认为H3分子实质上是H2分子与H+以特殊共价键结合的产物,应写成H
D.丁认为如果上述的发现存在,则证明传统的价键理论有一定的局限性有待继续发展
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰气的分子式为(CN)2,结构式为N![]() C-C
C-C![]() N,性质与卤素相似,下列叙述正确的是
N,性质与卤素相似,下列叙述正确的是
A. 分子中四原子共直线,是非极性分子 B. N![]() C 键的键长大于C
C 键的键长大于C![]() C键的键长
C键的键长
C. 分子中含有2个σ键和4个π键 D. 氰气不和氢氧化钠溶液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用如图所示的实验装置进行铁与水蒸气的实验,并研究铁及其化合物的部分性质。

请回答下列问题:
(1)硬质试管中发生反应的化学方程式为______________________。
(2)该同学为确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色,则说明硬质试管的固体物质中一定有____,可能有____;若溶液未变红色,则说明硬质试管中固体物质的成分是____________________。
(3)该同学按(2)中所述实验方案进行了实验,结果溶液未变红色,原因是___________(用离子方程式表示)。
(4)该同学马上另取少量溶液B,使其与NaOH溶液反应。若按下图所示操作,可观察到试管中先生成白色沉淀,后沉淀迅速变成灰绿色,最后变成红褐色的现象,请写出白色沉淀变为红褐色的过程中所发生反应的化学方程式:______________________________。

(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明Fe2+具有____________性。由此可知,实验室中含有Fe2+的盐溶液需现用现配制的原因是____________________,并且配制含Fe2+的盐溶液时应加入少量____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的氯化钠晶体,但现在只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案:

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
请回答下列问题:
(1)操作①加热的目的是________________,
(2)操作②除用BaCl2溶液外,还可用____________替代。
(3)操作②,判断SO42-已除尽的方法是________________________。
(4)操作③的目的是____________,不先过滤后再加Na2CO3溶液的理由是____________。
(5)操作④的名称是______________,应在________(填仪器名称)中进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】安全是顺利进行实验及避免伤害的保障.下列实验操作正确且不是从实验安全角度考虑的是( )

A. 操作①:使用稍浸入液面下的倒扣漏斗检验氢气的纯度
B. 操作②:使用CCl4萃取溴水中的溴时,振荡后需打开活塞使漏斗内气体放出
C. 操作③:吸收氨气或氯化氢气体并防止倒吸
D. 操作④:用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含重金属离子(如铬、锰、铅等)废水的常见治理方法有化学还原法、化学氧化法、吸附法等工艺.
(1)化学还原法除Cr2O72-:取含Cr2O72-的模拟水样,分别在不同pH条件下,向每个水样中分别加一定量的FeSO4、NaHSO3,搅拌,充分反应,然后滴加Ca(OH)2悬浊液,静置沉淀,测定铬去除率,实验结果如图1所示。

①在酸性条件下,NaHSO3使Cr2O72-还原成为Cr3+,请写出NaHSO3与Cr2O72-反应的离子方程式:_____________
②pH>8时,亚铁盐对+6价Cr的去除效果反而下降,可能的原因是__________
③分析比较亚铁盐和亚硫酸盐去除+6价Cr的效果。
Ⅰ.亚铁盐在中性和碱性条件下,对+6价Cr的去除效果优于酸性条件下的去除效果,亚硫酸盐则相反;Ⅱ.____________。
(2)化学氧化法除Mn2+:
①相同条件下,按Ⅰ、Ⅱ两种方案氧化除去水样中Mn2+,测定不同pH,相同反应时间的c(Mn2+),结果如图2所示,产生该差异的可能原因是__________

②氧化实验中除Mn2+的最佳条件为_________
(3)石墨烯吸附法除Pb2+:不同的pH会使石墨烯吸附剂表面带上不同的电荷,图3为pH对Pb2+吸附率的影响,发生如图变化的原因是______________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列化学反应的方程式
①制备氢氧化铁胶体的化学方程式 :_____________________________。
②硫酸镁溶液和氢氧化钡溶液反应的离子方程式:______________________。
③醋酸和氢氧化钠溶液反应的离子方程式:_______________________________。
④金属铝投入氢氧化钠溶液中的化学方程式:_______________________________。
⑤还原铁粉与水蒸气反应的化学方程式:__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com