
 一定条件下,在绝热恒容2L密闭容器中进行反应:N2(g)+3H2(g)?2NH3(g)+Q,若反应过程中n(H2)和n(NH3)随时间变化的关系如图所示,则下列有关叙述中一定正确的是( )
一定条件下,在绝热恒容2L密闭容器中进行反应:N2(g)+3H2(g)?2NH3(g)+Q,若反应过程中n(H2)和n(NH3)随时间变化的关系如图所示,则下列有关叙述中一定正确的是( )| A、若在t2时刻再充入一定量He,达平衡时C(H2)<0.4mol/L |
| B、a点表示NH3生成速率与NH3分解速率相等 |
| C、b点和c点H2的转化率相等 |
| D、若在t1时刻再充入一定量H2,达平衡时化学平衡常数变小 |


科目:高中化学 来源: 题型:
| A、23.8% |
| B、33.4% |
| C、35.6% |
| D、63.8% |
查看答案和解析>>
科目:高中化学 来源: 题型:
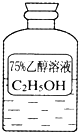 油价的持续“高烧”,引发人们对未来能源供需及价格的深切关注,并且促使人们寻求石油的替代品.
油价的持续“高烧”,引发人们对未来能源供需及价格的深切关注,并且促使人们寻求石油的替代品.| 编号 | ① | ② | ③ |
| 装置 | 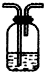 | 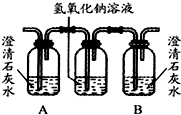 |  |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、温度为298K时,pH<7 |
| B、c(CH3COOH)+c(CH3COO-)=0.1 mol?L-1 |
| C、c(CH3COOH)<c(CH3COO-) |
| D、c(CH3COO-)+c(OH-)=c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 e.
e. f.
f.

查看答案和解析>>
科目:高中化学 来源: 题型:
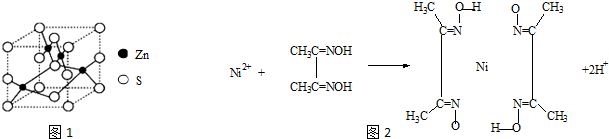
查看答案和解析>>
科目:高中化学 来源: 题型:
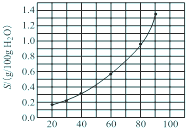 溴酸银(AgBrO3)的溶解度随温度变化曲线如图所示,下列说法错误的是( )
溴酸银(AgBrO3)的溶解度随温度变化曲线如图所示,下列说法错误的是( )| A、温度升高时溴酸银溶解速度加快 |
| B、溴酸银的溶解是放热过程 |
| C、60℃时,溴酸银的Ksp约等于6×10-4 |
| D、常温下溴酸银微溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com