
【题目】“绿色”和“生态文明”是未来的发展主题,而CO2的有效利用可以缓解温室效应,解决能源短缺问题。
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H
2CO(g)+2H2(g) △H
已知:反应1 CH4(g)═C(s)+2H2(g) △H1= +75kJ/mol
反应2 2CO(g)═C(s)+CO2(g) △H2=-172kJ/mol
则该催化重整反应的△H=___kJmol-1。
(2)有科学家提出可利用FeO吸收CO2:6FeO(s)+CO2(g)![]() 2Fe3O4(s)+C(s),对该反应的描述正确的是__。
2Fe3O4(s)+C(s),对该反应的描述正确的是__。
A.增大FeO的投入量,利于平衡正向移动
B.压缩容器体积,可增大CO2的转化率,c(CO2)减小
C.恒温恒容下,气体的密度不变可作为平衡的标志
D.恒温恒压下,气体摩尔质量不变可作为平衡的标志
E.若该反应的△H﹤0,则达到化学平衡后升高温度,CO2的物质的量会增加
(3)为研究CO2与CO之间的转化,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)![]() 2CO(g) H,测得压强、温度对CO的体积分数[φ(CO)%]的影响如图所示,回答下列问题:
2CO(g) H,测得压强、温度对CO的体积分数[φ(CO)%]的影响如图所示,回答下列问题:
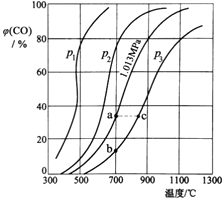
①图中p1、p2、p3的大小关系是______,图中a、b、c三点对应的平衡常数Ka、Kb、Kc的大小关系是______。
②900℃、1.013MPa时,1molCO2与足量碳反应达平衡后容器的体积为VL,CO2的转化率为___(保留一位小数),该反应的平衡常数K=___。
③将②中平衡体系温度降至640℃,压强降至0.1013MPa,重新达到平衡后CO2的体积分数为50%。条件改变时,正反应速率______逆反应速率(填“>”、“<”或“=”)。
(4)在NaOH溶液中通入一定量的CO2气体,所得溶液中c(HCO3-):c(CO32-)=4:1,此时溶液pH=______。(已知:室温下,H2CO3的k1=4×10-7,k2=5×10-11。lg2=0.3)
【答案】+247 CE p1<p2<p3 Ka=Kb<Kc 66.7% ![]() < 9.7
< 9.7
【解析】
(1)根据盖斯定律,将已知的两个热化学方程式叠加,可得催化重整的热化学方程式的反应热;
(2)根据化学平衡状态的特征及外界条件对化学平衡移动的影响分析判断;
(3)①反应C(s)+CO2(g)![]() 2CO(g)是气体分子数增多的反应,随着反应进行,体系压强增大;化学平衡常数只随温度的改变而改变;
2CO(g)是气体分子数增多的反应,随着反应进行,体系压强增大;化学平衡常数只随温度的改变而改变;
②900℃、1.013MPa时,平衡时CO的体积分数为80%,计算CO2转化的量,转化率就是转化的量与起始量比值的百分数,将各组分的平衡浓度代入平衡常数表达式计算化学平衡常数;
③根据改变条件前后CO2的体积分数的变化判断,根据反应商判断化学反应的方向;
(4)所得溶液c(HCO3-):c(CO32-)=4:1,根据K2=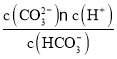 =5×10-11,计算c(H+),再根据pH=-lgc(H+)计算溶液pH。
=5×10-11,计算c(H+),再根据pH=-lgc(H+)计算溶液pH。
(1)①CH4(g)═C(s)+2H2(g) △H1= +75kJ/mol
②2CO(g)═C(s)+CO2(g) △H2=-172kJ/mol
根据盖斯定律,将热化学方程式①-②,整理可得:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H=+(75+172)kJ/mol=+247kJ/mol;
2CO(g)+2H2(g) △H=+(75+172)kJ/mol=+247kJ/mol;
(2) A.FeO是固体,增大FeO的投入量,不能使化学平衡发生移动,A错误;
B.该反应的正反应是气体体积减小的反应,压缩容器体积,即增大压强,化学平衡向气体体积减小的正反应方向移动,最终达到平衡时CO2的转化率增大,但平衡移动的趋势是微弱的,不能抵消。又由于压缩体积导致的物质的浓度增大,因此平衡时c(CO2)增大,B错误;
C.恒温恒容时,气体的质量是变量,容器的容积不变,气体的密度也为变量,若气体密度不变,则反应达到平衡状态,因此可作为平衡的标志,C正确;
D.反应混合物中只有CO2为气体,恒温恒压下,气体摩尔质量始终不变,因此不可作为平衡的标志,D错误;
E.若该反应的△H﹤0,则达到化学平衡后,若升高温度,化学平衡逆向移动,最终达到平衡时CO2的物质的量会增加,E正确;
故合理选项是CE;
(3)①反应C(s)+CO2(g)![]() 2CO(g)是气体体积增大的反应,随着反应进行,体系压强增大。减小压强有助于化学平衡正向移动,表明压强低时对应着的CO体积分数较高,则p1、p2、p3的大小关系是:p1<p2<p3;
2CO(g)是气体体积增大的反应,随着反应进行,体系压强增大。减小压强有助于化学平衡正向移动,表明压强低时对应着的CO体积分数较高,则p1、p2、p3的大小关系是:p1<p2<p3;
化学平衡常数只随温度的改变而改变,在压强不变时,升高温度,CO含量增大,说明升高温度,化学平衡正向移动,化学平衡常数增大,因此a、b、c三点对应的平衡常数大小关系是:Ka=Kb<Kc;
②900℃、1.013MPa时,设反应转化的CO2的物质的量为xmol,则平衡时n(CO)=2x,n(CO2)=1-x,根据图象可知平衡时CO的体积分数为80%,则![]() ×100%=80%,解得x=
×100%=80%,解得x=![]() ,所以CO2的转化率为:
,所以CO2的转化率为:![]() ×100%=66.7%;
×100%=66.7%;
平衡时各种气体的浓度,c(CO)=![]() ,c(CO2)=
,c(CO2)=![]() ,所以根据化学平衡常数的含义,可得此时反应的化学平衡常数K=
,所以根据化学平衡常数的含义,可得此时反应的化学平衡常数K=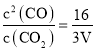 ;
;
③反应C(s)+CO2(g)![]() 2CO(g)的正反应是气体分子数增大的吸热反应,降低压强,升高温度均有利于反应正向进行,所以将②中平衡体系温度降至640℃,压强降至0.1013 MPa,降低温度减小压强,使正、逆反应速率均减小,重新达到平衡后CO2的体积分数为50%,设反应转化的CO2的物质的量为ymol,则平衡时n(CO2)=1-y,n(CO)=2y,则:
2CO(g)的正反应是气体分子数增大的吸热反应,降低压强,升高温度均有利于反应正向进行,所以将②中平衡体系温度降至640℃,压强降至0.1013 MPa,降低温度减小压强,使正、逆反应速率均减小,重新达到平衡后CO2的体积分数为50%,设反应转化的CO2的物质的量为ymol,则平衡时n(CO2)=1-y,n(CO)=2y,则:![]() =50%,解得y=
=50%,解得y=![]() mol<
mol<![]() mol,可见重新达到平衡时,体系中CO含量降低,CO2含量升高,即化学平衡向逆反应方向移动,所以v(正)<v(逆);
mol,可见重新达到平衡时,体系中CO含量降低,CO2含量升高,即化学平衡向逆反应方向移动,所以v(正)<v(逆);
(4)所得溶液c(HCO3-):c(CO32-)=4:1,由于K2=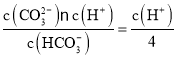 =5×10-11,则c(H+)=2.0×10-10,所以溶液的pH=-lgc(H+)=10-0.3=9.7。
=5×10-11,则c(H+)=2.0×10-10,所以溶液的pH=-lgc(H+)=10-0.3=9.7。


科目:高中化学 来源: 题型:
【题目】某同学制作的燃料电池示意图如下,先闭合K1接通电源一段时间后,再断开K1、闭合K2 时,电流表指针偏转。下列分析正确的是

A.闭合K1时,Na2SO4开始电离
B.闭合K1时,石墨a 附近溶液逐渐变红
C.断开K1、闭合K2时,石墨a 附近溶液酸性逐渐减弱
D.断开K1、闭合K2时,石墨b极上发生反应:H22e-=2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g) ![]() Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
A. 若增大压强,则物质Y的转化率减小
B. 将容器体积变为20 L,Z的平衡浓度变为原来的![]()
C. 以X的浓度变化表示的反应速率为0.001 mol/(L·s)
D. 若升高温度,X的体积分数增大,则该反应的ΔH >0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,将0.5mol/L的氨水逐滴加入10.00mL0.5mol/L盐酸中,溶液中温度变化曲线Ⅰ、pH变化曲线Ⅱ与加入氨水的体积的关系如图所示(忽略混合时溶液体积的变化)。下列说法正确的是( )

A.Kw的比较:a点比b点大
B.b点氨水与盐酸恰好完全反应,且溶液中c(NH4+)=c(Cl-)
C.c点时溶液中c(NH4+)=c(Cl-)=c(OH-)=c(H+)
D.d点时溶液中c(NH3H2O)+2c(OH-)=c(NH4+)+2c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,发生反应:2A(g)+B(s)![]() C(g)+D(g),下列描述中能表明反应已达到平衡状态的是
C(g)+D(g),下列描述中能表明反应已达到平衡状态的是
①混合气体的压强不变
②混合气体的密度不变
③C(g)的物质的量浓度不变
④容器内A、C、D三种气体的浓度之比为2:1:1
⑤单位时间内生成n molD,同时生成2n mol A
⑥单位时间内生成n molC,同时消耗n mol D
A. ①②③ B. ③④⑥ C. ②③⑤⑥ D. 只有 ③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种物质均含有铝元素,在溶液中的转化关系如图所示。下列说法正确的是
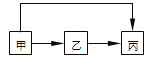
A. 若甲是Al,丙是Al(NO3)3,则乙一定是NaAlO2
B. 若甲是Al2O3,丙是NaAlO2,则乙一定是Al(NO3)3
C. 若甲是Al(NO3)3,丙是NaAlO2,则乙一定是Al(OH)3
D. 若甲是Al(OH)3,丙是Al(NO3)3,则乙一定是NaAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子组成为C9H12苯的同系物,已知苯环上只有一个取代基,下列说法中正确
A.该有机物不能发生加成反应,但能发生取代反应
B.该有机物不能使酸性高锰酸钾溶液褪色,但能使溴水褪色
C.该有机物分子中的所有原子可能在同一平面上
D.该有机物的一溴代物最多有6种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物6.4 g在氧气中完全燃烧,只生成8.8 g CO2和7.2 g H2O。下列说法正确
A.该化合物仅含碳、氢两种元素B.该化合物中碳、氢原子个数比为1:3
C.无法确定该化合物是否含有氧元素D.该化合物中一定含有氧元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示物质结构的化学用语或模型正确的是
A. HF的电子式:![]() B. 用核素符号表示中子:
B. 用核素符号表示中子:![]()
C. HClO的结构式:H-Cl-O D. 用电子式表示CO2的形成过程: ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com