
【题目】某化合物6.4 g在氧气中完全燃烧,只生成8.8 g CO2和7.2 g H2O。下列说法正确
A.该化合物仅含碳、氢两种元素B.该化合物中碳、氢原子个数比为1:3
C.无法确定该化合物是否含有氧元素D.该化合物中一定含有氧元素
 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,将3molA气体和1molB气体通入一密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)请填写下列空白:
xC(g)请填写下列空白:
(1)若容器体积固定为2L,反应2min时测得剩余0.6molB,C的浓度为0.4mol/L。
①2min内,A的平均反应速率为________;x=_______;
②若反应经4min达到平衡,平衡时C的浓度__________0.8mol/L填“大于”、“等于”或“小于”![]() ;
;
(2)若维持容器压强不变:达到平衡时C的体积分数________22%填“大于”、“等于”或“小于”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色”和“生态文明”是未来的发展主题,而CO2的有效利用可以缓解温室效应,解决能源短缺问题。
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H
2CO(g)+2H2(g) △H
已知:反应1 CH4(g)═C(s)+2H2(g) △H1= +75kJ/mol
反应2 2CO(g)═C(s)+CO2(g) △H2=-172kJ/mol
则该催化重整反应的△H=___kJmol-1。
(2)有科学家提出可利用FeO吸收CO2:6FeO(s)+CO2(g)![]() 2Fe3O4(s)+C(s),对该反应的描述正确的是__。
2Fe3O4(s)+C(s),对该反应的描述正确的是__。
A.增大FeO的投入量,利于平衡正向移动
B.压缩容器体积,可增大CO2的转化率,c(CO2)减小
C.恒温恒容下,气体的密度不变可作为平衡的标志
D.恒温恒压下,气体摩尔质量不变可作为平衡的标志
E.若该反应的△H﹤0,则达到化学平衡后升高温度,CO2的物质的量会增加
(3)为研究CO2与CO之间的转化,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)![]() 2CO(g) H,测得压强、温度对CO的体积分数[φ(CO)%]的影响如图所示,回答下列问题:
2CO(g) H,测得压强、温度对CO的体积分数[φ(CO)%]的影响如图所示,回答下列问题:
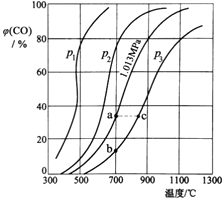
①图中p1、p2、p3的大小关系是______,图中a、b、c三点对应的平衡常数Ka、Kb、Kc的大小关系是______。
②900℃、1.013MPa时,1molCO2与足量碳反应达平衡后容器的体积为VL,CO2的转化率为___(保留一位小数),该反应的平衡常数K=___。
③将②中平衡体系温度降至640℃,压强降至0.1013MPa,重新达到平衡后CO2的体积分数为50%。条件改变时,正反应速率______逆反应速率(填“>”、“<”或“=”)。
(4)在NaOH溶液中通入一定量的CO2气体,所得溶液中c(HCO3-):c(CO32-)=4:1,此时溶液pH=______。(已知:室温下,H2CO3的k1=4×10-7,k2=5×10-11。lg2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、![]() 、Mg2+、Al3+、Fe3+、
、Mg2+、Al3+、Fe3+、![]() 、
、![]() 、
、![]() 中的几种。
中的几种。
①若加入锌粒,用排空气法收集到无色无味气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法不正确的是( )
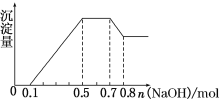
A.溶液中的阳离子有H+、Mg2+、Al3+、![]()
B.溶液中n(Mg2+)=0.1 mol
C.溶液中一定不含![]() 、
、![]() 、Fe3+
、Fe3+
D.n(![]() ∶n(Al3+)∶n(Mg2+)=4∶2∶1
∶n(Al3+)∶n(Mg2+)=4∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物D是硅橡胶的稳定剂,其合成路线如下图
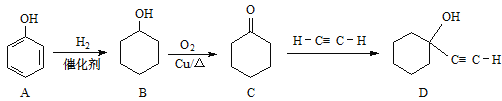
(1)B的分子式为____; C中官能团名称___。
(2)C→D的反应类型为___。
(3)B→C的化学方程式为___。
(4)化合物D可能具有的性质有___(选填序号)。
a.与FeCl3溶液发生显色反应
b.加成反应
c.消去反应
d.酯化反应
(5)化合物B经3步反应可制备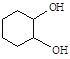 ,反应类型依次是___(选填序号)。
,反应类型依次是___(选填序号)。
a.加成 、 取代、 消去
b.消去、加成、取代
c.取代、消去、加成
(6)写出同时满足下列条件的A的一种同分异构体的结构简式_____。
①核磁共振氢谱只有一个峰
②分子中没有碳碳双键也无环状结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,如下图是从该矿渣中回收NiSO4的工艺路线:
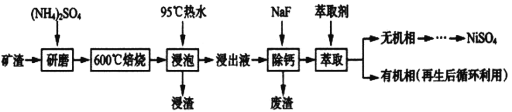
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4,NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。锡(Sn)位于第五周期第IVA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是_______________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为_________________________,“浸渣”的成分除Fe2O3、FeO(OH)外还含有___________________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将:Fe3+还原为Fe2+,所需SnC12的物质的量不少于Fe3+物质的量的_____倍:除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为_________________________________________。
(4)“浸出液”中c(Ca2+)=1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-)=___mol· L-1。[已知KSP(CaF2)=4.0×10-11]
(5)已知正十二烷可用作该工艺的萃取剂。用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷。已知电解总反应为:2C6H13COONa+2CH3OH![]() C12H26+2CO2↑+H2↑+2CH3ONa,则阳极的电极反应式为______________________________________
C12H26+2CO2↑+H2↑+2CH3ONa,则阳极的电极反应式为______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氢键,下列说法正确的是( )
A. 每一个水分子内含有两个氢键
B. 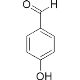 的熔沸点明显高于
的熔沸点明显高于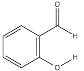 ,对羟基苯甲醛分子间存在氢键,而邻羟基苯甲醛存在分子内氢键。
,对羟基苯甲醛分子间存在氢键,而邻羟基苯甲醛存在分子内氢键。
C. H2O是一种非常稳定的化合物,这是由于氢键所致
D. SO2易溶于水,重要的原因之一是由于SO2与H2O之间能形成氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料。请回答:
(1)基态铜原子的电子排布式为_______________;已知高温下CuO→Cu2O+O2,从铜原子价层电子结构(3d和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是_________________________。
(2)硒、硅均能与氢元素形成气态氢化物,则它们形成的组成最简单的氢化物中,分子构型分别为____________,若“Si—H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se____Si(填“>”、“<”)。
(3)SeO2常温下白色晶体,熔点为340~350℃,315℃时升华,则SeO2固体的晶体类型为_________;若SeO2类似于SO2是V型分子,则Se原子外层轨道的杂化类型为_________。
(4)与镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物,如BF3能与NH3反应生成BF3·NH3。BF3·NH3中B原子的杂化轨道类型为______,B与N之间形成_________键。
(5)金刚砂(SiC)的硬度为9.5,其晶胞结构如图所示;则金刚砂晶体类型为________,在SiC中,每个C原子周围最近的C原子数目为___个;若晶胞的边长为a pm,则金刚砂的密度表达式为_________g/cm3。
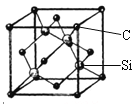
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案不能达到实验目的是
实验目的 | 实验方案 | |
A | 证明溴乙烷发生消去反应有乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反产生的气体通入溴的四氯化碳溶液 |
B | 检验卤代烃中卤原子的种类 | 将溴乙烷与氢氧化钠溶液共热,取冷却后反应液,向其中滴加硝酸酸化后的硝酸银溶液 |
C | 检验 | 将 |
D | 验证苯和液溴在 | 将反应产生的混合气体先通入四氯化碳溶液再通入 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com