
【题目】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,如下图是从该矿渣中回收NiSO4的工艺路线:
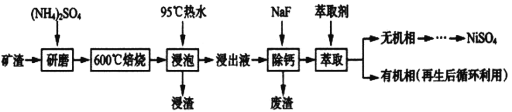
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4,NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。锡(Sn)位于第五周期第IVA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是_______________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为_________________________,“浸渣”的成分除Fe2O3、FeO(OH)外还含有___________________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将:Fe3+还原为Fe2+,所需SnC12的物质的量不少于Fe3+物质的量的_____倍:除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为_________________________________________。
(4)“浸出液”中c(Ca2+)=1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-)=___mol· L-1。[已知KSP(CaF2)=4.0×10-11]
(5)已知正十二烷可用作该工艺的萃取剂。用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷。已知电解总反应为:2C6H13COONa+2CH3OH![]() C12H26+2CO2↑+H2↑+2CH3ONa,则阳极的电极反应式为______________________________________
C12H26+2CO2↑+H2↑+2CH3ONa,则阳极的电极反应式为______________________________________
【答案】增大接触面积,加快反应速率,使反应更充分 Fe3++2H2O![]() FeO(OH)↓+3H+ SiO2、CaSO4 0.5 Cr2O72- +6Fe2++14H+ =2Cr3++6Fe3++7H2O c (F- ) =2.0×10-3 mol·L-1 2C6H13COO--2e- =C12H26+2CO2↑
FeO(OH)↓+3H+ SiO2、CaSO4 0.5 Cr2O72- +6Fe2++14H+ =2Cr3++6Fe3++7H2O c (F- ) =2.0×10-3 mol·L-1 2C6H13COO--2e- =C12H26+2CO2↑
【解析】
(1)研磨可增大接触面积,使反应速率加快;
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)为水解反应,矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,加入硫酸铵加热浸取后的浸渣为不反应和不溶于水的硫酸钙和二氧化硅;
(3)用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,根据氧化还原反应的定量关系计算得到SnC12的物质的量不少于Fe3+物质的量的倍数,用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,由此分析离子方程式的书写;
(4)“浸出液”中c(Ca2+)=1.0×10-3mol·L-1,当除钙率达到99%时,剩余的Ca2+为1%×1.0×10-3mol·L-1=1.0×10-5mol·L-1,结合Ksp得计算公式计算出c(F-);
(5)由电解的总反应可知,C6H13COONa 生成C12H26,C元素化合价升高,被氧化,为阳极反应。
(1)研磨可增大接触面积,使反应速率加快,使反应更充分;
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)为水解反应,反应的离子方程式为:Fe3++2H2O![]() FeO(OH)↓+3H+,加入硫酸铵加热浸取后的浸渣为不反应和不溶于水的CaS04和SiO2;
FeO(OH)↓+3H+,加入硫酸铵加热浸取后的浸渣为不反应和不溶于水的CaS04和SiO2;
(3)用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,反应为2Fe3++Sn2+= Sn4++2Fe2+,所需SnC12的物质的量不少于Fe3+物质的量的一半,为0.5倍;用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,反应的离子方程式为:Cr2O72- +6Fe2++14H+ =2Cr3++6Fe3++7H2O;
(4)“浸出液”中c(Ca2+)=1.0×10-3mol·L-1,当除钙率达到99%时,剩余的Ca2+为1%×1.0×10-3mol·L-1=1.0×10-5mol·L-1,那么c(F-)=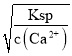 =
=![]() =2.0×10-3mol/L;
=2.0×10-3mol/L;
(5)C6H13COONa 生成C12H26,C元素化合价升高,被氧化,为阳极反应,电极反应为:2C6H13COO--2e- =C12H26+2CO2↑。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
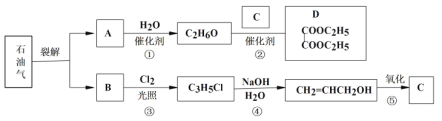
【题目】石油是工业的血液,通过它可以得到很多重要的化工产品。
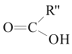
已知: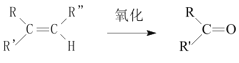 +
+
(1)B和A为同系物,B的结构简式为____,其含有的官能团名称为____。
(2)反应①的化学方程式为___,其反应类型为____。
(3)写出检验C3H5Cl中含有的Cl原子的方法____。
(4)C的结构简式为___。
(5)反应④的化学方程式为_____。
(6)设计一条由乙烯为原料制备D的合成路线(其他无机原料任选)。___
合成路线流程图示例如下:CH3CH2OH![]() CH2=CH2
CH2=CH2![]() BrH2C-CH2Br。
BrH2C-CH2Br。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种物质均含有铝元素,在溶液中的转化关系如图所示。下列说法正确的是
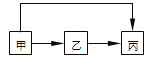
A. 若甲是Al,丙是Al(NO3)3,则乙一定是NaAlO2
B. 若甲是Al2O3,丙是NaAlO2,则乙一定是Al(NO3)3
C. 若甲是Al(NO3)3,丙是NaAlO2,则乙一定是Al(OH)3
D. 若甲是Al(OH)3,丙是Al(NO3)3,则乙一定是NaAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)如何用实验证明绿矾中的铁是二价铁而不是三价铁_______________
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。
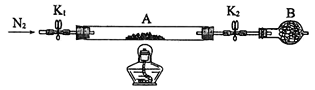
①仪器B的名称是____________________。
②将下列实验操作步骤正确排序______________(填标号);重复上述操作步骤,直至A恒
重,记为m3 g。
a.点燃酒精灯,加热 b.打开K1和K2,缓缓通入N2
c.关闭K1和K2 d.熄灭酒精灯 e.称量A f.冷却到室温
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
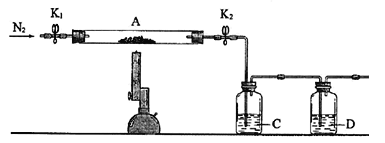
①C中的溶液为BaCl2,其作用是______________
②写出硫酸亚铁高温分解反应的化学方程式_____________________。
③有同学认为该实验装置存在一定缺陷,请你谈谈完善该试验装置的措施_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物6.4 g在氧气中完全燃烧,只生成8.8 g CO2和7.2 g H2O。下列说法正确
A.该化合物仅含碳、氢两种元素B.该化合物中碳、氢原子个数比为1:3
C.无法确定该化合物是否含有氧元素D.该化合物中一定含有氧元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于Na2CO3 和NaHCO3的叙述不正确的是
A.在相同情况下,Na2CO3 比NaHCO3易溶于水
B.温度相同,浓度相同Na2CO3 溶液的碱性比NaHCO3溶液碱性强
C.可用相同的离子方程式表示Na2CO3 和NaHCO3分别与Ca(OH)2溶液的反应
D.等质量的Na2CO3 和NaHCO3分别与足量的盐酸溶液反应,后者放出的CO2多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值。下列说法正确的是
A.25℃,1LpH=13的氢氧化钡溶液中含OH-的数目为0.2NA
B.12.0gNaHSO4晶体中阳离子和阴离子的总数为0.3NA
C.标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2NA
D.4.2gCaH2与水完全反应,转移的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸苯乙酯有极强的抗炎和抗氧化活性而起到抗肿瘤的作用.现设计出如下路线合成缓释药物聚咖啡酸苯乙酯:
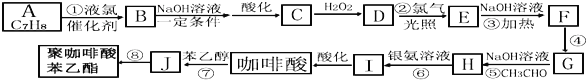
已知:B的核磁共振氢谱有三个波峰;红外光谱显示咖啡酸分子中存在碳碳双键;且:
![]() ;
;![]()
![]() 咖啡酸仅含C、H、O三种元素,蒸气密度是相同条件下
咖啡酸仅含C、H、O三种元素,蒸气密度是相同条件下![]() 的90倍,含氧质量分数为
的90倍,含氧质量分数为![]() ,则咖啡酸的分子式为 ______ ;咖啡酸可与
,则咖啡酸的分子式为 ______ ;咖啡酸可与![]() 溶液反应生成气体,1mol咖啡酸与足量钠反应生成
溶液反应生成气体,1mol咖啡酸与足量钠反应生成![]()
![]() ,咖啡酸中所有含氧官能团的名称: _____;
,咖啡酸中所有含氧官能团的名称: _____;
![]() 写出下列反应的类型:
写出下列反应的类型:![]() ______ ,
______ ,![]() ______ .
______ .
![]() 写出反应
写出反应![]() 的化学方程式: ______ .
的化学方程式: ______ .
![]() 写出反应
写出反应![]() 的化学方程式: ______ .
的化学方程式: ______ .
![]() 满足下列条件的咖啡酸的同分异构体有 ______ 种.任写三种 ______ .
满足下列条件的咖啡酸的同分异构体有 ______ 种.任写三种 ______ .
![]() 含有两个羧基
含有两个羧基![]() 苯环上有三个取代基.
苯环上有三个取代基.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向体积为2L的恒容密闭容器中通入2molN2和6molH2,在一定条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g)。实验测得反应经5min后达到平衡,此时混合物的总物质的量为5.6mol,求:
2NH3(g)。实验测得反应经5min后达到平衡,此时混合物的总物质的量为5.6mol,求:
(1)平衡时NH3的浓度为___mol·L-1。
(2)0~5min内,v(H2)=___mol·L-1·min-1。
(3)反应达到平衡时,N2的转化率为___。
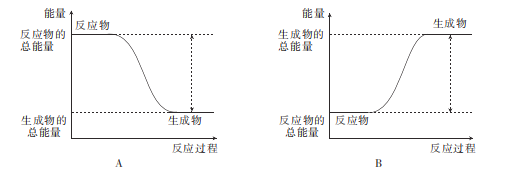
(4)下列图象中能反映该反应的能量变化的是___(填标号)。
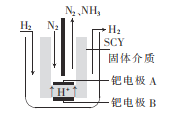
(5)若以N2和H2合成氨的反应设计如图所示的原电池,则通入N2的一极为__(填“正”或“负")极;负极的电极反应式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com