
【题目】设NA代表阿伏加德罗常数的值。下列说法正确的是
A.25℃,1LpH=13的氢氧化钡溶液中含OH-的数目为0.2NA
B.12.0gNaHSO4晶体中阳离子和阴离子的总数为0.3NA
C.标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2NA
D.4.2gCaH2与水完全反应,转移的电子数为0.1NA
【答案】C
【解析】
A. pH=13的氢氧化钡溶液中c(OH-)=![]() =
=![]() =0.1mol/L,进一步计算OH-的数目;
=0.1mol/L,进一步计算OH-的数目;
B. NaHSO4晶体中含有Na+和HSO4-,结合物质的量计算阴阳离子的总数;
C. 甲烷和乙烯氢原子数相同,结合物质的量判断氢原子的数目;
D. CaH2与水完全反应生成Ca(OH)2和H2,1mol CaH2参与反应电子转移2mol,据此进行计算。
A. pH=13的氢氧化钡溶液中c(OH-)=0.1mol/L,n(OH-)=0.1mol,因此溶液中含OH-的数目为0.1NA,A项错误;
B. NaHSO4晶体中含有Na+和HSO4-,12.0g(即0.1mol)NaHSO4晶体中阴离子的物质的量为0.1mol,阳离子的物质的量为0.1mol,因此晶体中阳离子和阴离子的总数为0.2NA,B项错误;
C. 甲烷和乙烯氢原子数相同,都是4,标况下11.2L甲烷和乙烯混合物的物质的量为0.5mol,因此氢原子的物质的量为0.5mol×4=2mol,因此混合物中含氢原子数目为2NA,C项正确;
D. 1mol CaH2参与反应电子转移2mol,4.2g(即0.1mol)CaH2与水完全反应,转移的电子为0.2mol,因此转移的电子数为0.2NA,D项错误;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在下列物质中是同系物的有_______;互为同分异构体的有_______________;互为同素异形体的有________________;互为同位素的有_______________;
互为同一物质的有______________;
(1)液氯 (2)氯气 (3)白磷 (4)红磷 (5)D (6)T (7) ![]() (8)
(8)![]() (9)CH2 = CH-CH3 (10)
(9)CH2 = CH-CH3 (10) ![]() (11)2,2—二甲基丁烷
(11)2,2—二甲基丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、![]() 、Mg2+、Al3+、Fe3+、
、Mg2+、Al3+、Fe3+、![]() 、
、![]() 、
、![]() 中的几种。
中的几种。
①若加入锌粒,用排空气法收集到无色无味气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法不正确的是( )
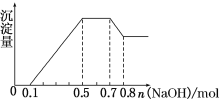
A.溶液中的阳离子有H+、Mg2+、Al3+、![]()
B.溶液中n(Mg2+)=0.1 mol
C.溶液中一定不含![]() 、
、![]() 、Fe3+
、Fe3+
D.n(![]() ∶n(Al3+)∶n(Mg2+)=4∶2∶1
∶n(Al3+)∶n(Mg2+)=4∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,如下图是从该矿渣中回收NiSO4的工艺路线:
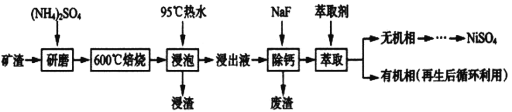
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4,NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。锡(Sn)位于第五周期第IVA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是_______________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为_________________________,“浸渣”的成分除Fe2O3、FeO(OH)外还含有___________________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将:Fe3+还原为Fe2+,所需SnC12的物质的量不少于Fe3+物质的量的_____倍:除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为_________________________________________。
(4)“浸出液”中c(Ca2+)=1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-)=___mol· L-1。[已知KSP(CaF2)=4.0×10-11]
(5)已知正十二烷可用作该工艺的萃取剂。用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷。已知电解总反应为:2C6H13COONa+2CH3OH![]() C12H26+2CO2↑+H2↑+2CH3ONa,则阳极的电极反应式为______________________________________
C12H26+2CO2↑+H2↑+2CH3ONa,则阳极的电极反应式为______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氢键,下列说法正确的是( )
A. 每一个水分子内含有两个氢键
B. 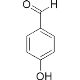 的熔沸点明显高于
的熔沸点明显高于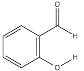 ,对羟基苯甲醛分子间存在氢键,而邻羟基苯甲醛存在分子内氢键。
,对羟基苯甲醛分子间存在氢键,而邻羟基苯甲醛存在分子内氢键。
C. H2O是一种非常稳定的化合物,这是由于氢键所致
D. SO2易溶于水,重要的原因之一是由于SO2与H2O之间能形成氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上冶炼钛的有关反应如下所示:
① C(s) + O2(g) ![]() CO2(g) ΔH1
CO2(g) ΔH1
② 2CO(g) + O2(g) ![]() 2CO2(g) ΔH2
2CO2(g) ΔH2
③ TiO2(s) + 2Cl2(g) ![]() TiCl4(g) + O2(g) ΔH3
TiCl4(g) + O2(g) ΔH3
④ TiCl4(s) + 2Mg(s) ![]() 2MgCl2(s) + Ti(s) ΔH4
2MgCl2(s) + Ti(s) ΔH4
⑤ TiO2(s) + 2Cl2(g) + 2C(s) ![]() TiCl4(g) + 2CO(g) ΔH5
TiCl4(g) + 2CO(g) ΔH5
下列有关推断正确的是( )
A. 2ΔH1=ΔH2 B. ΔH1<0,ΔH2>0
C. ΔH5=ΔH3+2ΔH1-ΔH2 D. 2ΔH1-ΔH2>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料。请回答:
(1)基态铜原子的电子排布式为_______________;已知高温下CuO→Cu2O+O2,从铜原子价层电子结构(3d和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是_________________________。
(2)硒、硅均能与氢元素形成气态氢化物,则它们形成的组成最简单的氢化物中,分子构型分别为____________,若“Si—H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se____Si(填“>”、“<”)。
(3)SeO2常温下白色晶体,熔点为340~350℃,315℃时升华,则SeO2固体的晶体类型为_________;若SeO2类似于SO2是V型分子,则Se原子外层轨道的杂化类型为_________。
(4)与镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物,如BF3能与NH3反应生成BF3·NH3。BF3·NH3中B原子的杂化轨道类型为______,B与N之间形成_________键。
(5)金刚砂(SiC)的硬度为9.5,其晶胞结构如图所示;则金刚砂晶体类型为________,在SiC中,每个C原子周围最近的C原子数目为___个;若晶胞的边长为a pm,则金刚砂的密度表达式为_________g/cm3。
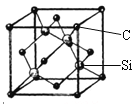
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁铝合金具有良好的强度、刚性、优良的电磁屏蔽性和导热性,使之成为笔记本电脑和轻薄手机的首选外壳材料。为测定某手机外壳镁铝合金中镁和铝的含最,并回收镁铝,某实验小组设计如下实验方案。
①除去手机外壳的涂层,剪其中一小块,称取其质量;
②组装仪器,检查气密性,用足盘稀盐酸溶解合金;
③测量产生气体的体积,计算结果;
④利用下列流程,从溶解合金后的溶液中回收分离镁铝。
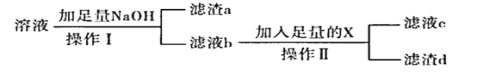
(1)请利用下图给定的仪器组成一套实验装置(每个仪器只能使用一次,可不选用)。各种仪器连接的先后顺序(用小写字母表示)_______

(2)除了测定产生气体的体积外,还应测定_______。
(3)回收流程中,操作I需要的玻璃仪器有烧杯、玻璃棒和_______,为保证回收产品的纯度,操作I后应_______。
(4)滤液b的溶质是_______(填化学式),试剂X是_______。
(5)向滤渣a中加入盐酸,产物是_______(填化学式),若从晶体中获得金属,应进行的操作是_______。
(6)若从除去涂层的手机壳上取样品mg加入足量盐酸后,测得产生的气体nL,实验条件下的气体摩尔体积为VmL/mol,则合金中Mg的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,某一气态平衡体系中含有X、Y、Z、W四种气体物质,此温度下发生反应的平衡常数表达式为:![]() ,有关该平衡体系的说法正确的是( )
,有关该平衡体系的说法正确的是( )
A.升高温度,平衡常数K增大 ,则正反应为吸热反应
B.增大压强,W质量分数增加
C.增大X浓度,平衡向正反应方向移动
D.升高温度,若混合气体的平均相对分子质量变大,则正反应是放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com