
【题目】某溶液中可能含有H+、![]() 、Mg2+、Al3+、Fe3+、
、Mg2+、Al3+、Fe3+、![]() 、
、![]() 、
、![]() 中的几种。
中的几种。
①若加入锌粒,用排空气法收集到无色无味气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法不正确的是( )
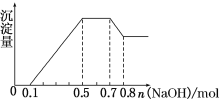
A.溶液中的阳离子有H+、Mg2+、Al3+、![]()
B.溶液中n(Mg2+)=0.1 mol
C.溶液中一定不含![]() 、
、![]() 、Fe3+
、Fe3+
D.n(![]() ∶n(Al3+)∶n(Mg2+)=4∶2∶1
∶n(Al3+)∶n(Mg2+)=4∶2∶1
【答案】B
【解析】
根据①可知,溶液显酸性,则溶液中一定不存在CO32-和NO3-,根据②可知,产生的是白色沉淀,说明不存在Fe3+,根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有Mg2+、Al3+,又因为当沉淀达到最大值时,继续加入氢氧化钠,沉淀不变,这说明溶液中还存在NH4+,根据溶液电中性可知,溶液中一定存在阴离子SO42-。
根据图象可知,第一阶段为氢离子与氢氧化钠反应,消耗氢氧化钠为0.1mol,则n(H+)=0.1mol,第三阶段为铵根离子与氢氧化钠反应,消耗氢氧化钠为0.7mol-0.5mol=0.2mol,则n(NH4+)=0.2mol,最后阶段为氢氧化钠溶解氢氧化铝,消耗氢氧化钠0.8mol-0.7mol=0.1mol,则n[Al(OH)3]=0.1mol,根据铝元素守恒可知n(Al3+)=0.1mol,第二阶段为氢氧化钠沉淀镁离子、铝离子,共消耗氢氧化钠为0.5mol-0.1mol=0.4mol,则n(Mg2+)=(0.4mol-0.1mol×3)×0.5=0.05mol。
A.由上述分析可知,溶液中的阳离子只有H+、Mg2+、Al3+、NH4+,故A选项正确。
B.根据以上分析可知,n(Mg2+)=0.05mol,故B选项错误。
C.由上述分析可知,溶液中一定不含CO32-、NO3-、Fe3+,故C选项正确。
D.由上述分析可知,溶液中n(NH4+):n(Al3+):n(Mg2+)=0.2mol:0.1mol:0.05mol=4:2:1,故D选项正确。
故答案选B。


科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F六种短周期元素,其中A 的一种原子不含中子;B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子;C元素的一种气体单质呈淡蓝色,D与B同周期,该周期中D的简单离子半径最小;E的单质是一种本身有毒可以用来消毒的气体;F 元素最高正价与最低负价的代数和为4。
(1)B、C、E 三元素组成的化合物之一,是家用消毒剂的主要成分,所含的化学键有______,其电子式为______。
(2)D、E、F 的简单离子半径由大到小的顺序是_________(用离子符号表示)。
(3)两种均含A、B、C、F 四种元素的化合物在溶液中相互反应的离子方程式__。
(4)一定量的石灰乳中通入一定量的E单质,两者恰好完全反应,生成物中有三种含E元素的离子.其中两种离子的物质的量(n) 与反应时间(t)的曲线如图所示。
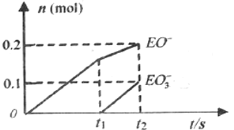
则t2时刻消耗氢氧化钙质量为______g,此时反应的化学方程为______。
(5)A、B 形成的化合物BA 在有机合成中用途很广泛.它可以夺取很多化合物中的质子而生成相应的钠的化合物,写出它与乙醇的化学方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,将0.5mol/L的氨水逐滴加入10.00mL0.5mol/L盐酸中,溶液中温度变化曲线Ⅰ、pH变化曲线Ⅱ与加入氨水的体积的关系如图所示(忽略混合时溶液体积的变化)。下列说法正确的是( )

A.Kw的比较:a点比b点大
B.b点氨水与盐酸恰好完全反应,且溶液中c(NH4+)=c(Cl-)
C.c点时溶液中c(NH4+)=c(Cl-)=c(OH-)=c(H+)
D.d点时溶液中c(NH3H2O)+2c(OH-)=c(NH4+)+2c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种物质均含有铝元素,在溶液中的转化关系如图所示。下列说法正确的是
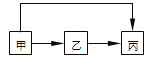
A. 若甲是Al,丙是Al(NO3)3,则乙一定是NaAlO2
B. 若甲是Al2O3,丙是NaAlO2,则乙一定是Al(NO3)3
C. 若甲是Al(NO3)3,丙是NaAlO2,则乙一定是Al(OH)3
D. 若甲是Al(OH)3,丙是Al(NO3)3,则乙一定是NaAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子组成为C9H12苯的同系物,已知苯环上只有一个取代基,下列说法中正确
A.该有机物不能发生加成反应,但能发生取代反应
B.该有机物不能使酸性高锰酸钾溶液褪色,但能使溴水褪色
C.该有机物分子中的所有原子可能在同一平面上
D.该有机物的一溴代物最多有6种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)如何用实验证明绿矾中的铁是二价铁而不是三价铁_______________
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。
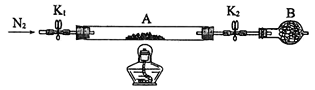
①仪器B的名称是____________________。
②将下列实验操作步骤正确排序______________(填标号);重复上述操作步骤,直至A恒
重,记为m3 g。
a.点燃酒精灯,加热 b.打开K1和K2,缓缓通入N2
c.关闭K1和K2 d.熄灭酒精灯 e.称量A f.冷却到室温
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
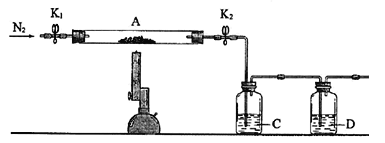
①C中的溶液为BaCl2,其作用是______________
②写出硫酸亚铁高温分解反应的化学方程式_____________________。
③有同学认为该实验装置存在一定缺陷,请你谈谈完善该试验装置的措施_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物6.4 g在氧气中完全燃烧,只生成8.8 g CO2和7.2 g H2O。下列说法正确
A.该化合物仅含碳、氢两种元素B.该化合物中碳、氢原子个数比为1:3
C.无法确定该化合物是否含有氧元素D.该化合物中一定含有氧元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值。下列说法正确的是
A.25℃,1LpH=13的氢氧化钡溶液中含OH-的数目为0.2NA
B.12.0gNaHSO4晶体中阳离子和阴离子的总数为0.3NA
C.标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2NA
D.4.2gCaH2与水完全反应,转移的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源危机当前是一个全球性问题,“开源节流”是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是__(填字母)。
A.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
B.大力开采煤、石油和天然气以满足人们日益增长的能源需求
C.开发太阳能、水能、风能、地热能等新能源,不使用煤、石油等化石燃料
D.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。
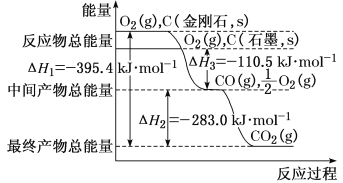
①在通常状况下,金刚石和石墨相比较,__(填“金刚石”或“石墨”)更稳定,石墨的燃烧热为ΔH=___。
②12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量为__kJ。
(3)已知:N2、O2分子中化学键的键能分别是946kJ·mol-1、497kJ·mol-1。N2(g)+O2(g)=2NO(g)ΔH=+180.0kJ·mol-1。NO分子中化学键的键能为__。
(4)综合上述有关信息,请写出用CO除去NO的热化学方程式:__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com