
【题目】一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”.如2Fe3++Cu=2Fe2++Cu2+,可拆写为氧化反应式:Cu→Cu2++2e-,还原反应式:2Fe3++2e-→2Fe2+.在稀硫酸中,KMnO4和H2O2能发生氧化还原反应5H2O2+2MnO+6H+===5O2↑+2Mn2++8H2O。
(1)将此氧化还原反应拆成半反应式,氧化式:_________,还原式:_________。
(2)反应中氧化剂是________;被氧化元素是__________;若有0.5 mol H2O2参加此反应,电子转移个数为____________。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为________________________;这时若有0.5 mol H2O2发生分解,电子转移个数为______。
【答案】 5H2O2-10e-===10H++5O2↑ 2MnO+10e-+16H+===2Mn2++8H2O KMnO4 氧元素 6.02×1023 2H2O2![]() 2H2O+O2↑ 3.01×1023
2H2O+O2↑ 3.01×1023
【解析】(1)因O元素的化合价升高,则氧化反应为5H2O2-10e-=10H++5O2↑,Mn元素的化合价降低,则还原反应为2MnO+10e-+16H+=2Mn2++8H2O;(2)反应物中Mn元素的化合价由+7价降低为+2价,则KMnO4为氧化剂;O元素的化合价由-1价升高到0价,则H2O2为还原剂,被氧化;根据反应式5H2O2-10e-=10H++5O2↑可知,若有0.5 mol H2O2参加此反应,电子转移个数为0.5 mol×![]() ×NAmol-1=NA=6.02×1023;(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为:2H2O2
×NAmol-1=NA=6.02×1023;(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为:2H2O2![]() 2H2O+O2↑;H2O2发生分解,氧元素化合价从-1价变化为0价和-2价,每2mol过氧化氢反应转移电子为2mol,若有0.5mol H2O2发生分解,则转移电子个数为0.5mol,即转移电子个数为3.01×1023。
2H2O+O2↑;H2O2发生分解,氧元素化合价从-1价变化为0价和-2价,每2mol过氧化氢反应转移电子为2mol,若有0.5mol H2O2发生分解,则转移电子个数为0.5mol,即转移电子个数为3.01×1023。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知KMnO4与浓盐酸反应的化学方程式为:2KMnO4+16HCl(浓)=2MnCl2+8H2O+2KCl+5Cl2↑,回答下列问题:
(1)该反应的离子方程式为________________________________________________。
(2)被氧化的HCl占HCl总量的__________________________。
(3)当标准状况下有11.2L氯气生成时,该反应转移的电子数为________________(设NA为阿伏加德罗常数的值)。
(4)15.8 g KMnO4与100 mL 12 mol/L浓盐酸完全反应(假设HCl无挥发),在反应后的溶液中加入足量的AgNO3溶液,可生成____________________g沉淀。(要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F为元素周期表中前四周期且原子序数依次增大的六种元素.其中A、B、C、D核电荷数之和为36,A、C原子的最外层电子数之和等于B原子 的次外层电子数,D原子质子数为B原子质子数的两倍,E元素所在主族均为金属,F的价电子数与C的核电荷数相等。
(1)下列关于上述几种元素的说法正确的是_________。
a.B、C、D的原子半径由大到小的顺序为:D >C >B
b.E、F的最外层电子数相等
c.A、B、C、D四种元素中电负性和第一电离能最大的均为B
d.B与C形成的化合物中可能含有非极性键
e.A、C、F都位于周期表的3区
(2)B单质有两种同素异形体.其中在水中溶解度较大的是_______(填化学式)。
(3)EA2和A2B熔点较高的是 _______(填化学式),原因是_________。
(4)D与B可以形成两种分子,其中DB2分子中心原子的杂化类型是____。下列分子或离子中与DB3结构相似的是____________。
a. NH3 b. SO32- c.NO3- d.PCl3
(5)已知B、F能形成两种化合物,其晶胞如下图所示.则高温时甲易转化为乙的原因为 ___________。若乙晶体密度为pg/cm3,则乙晶胞的晶胞边长a =________nm(用含P和NA的式子表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某样品中含有碳酸钠及少量的硫酸钠和氯化钠,某学生为检验其中的阴离子,按照下图程序进行实验,所加试剂均过量。(可供选择的试剂有:稀硫酸、稀盐酸、稀硝酸、BaCl2溶液、Ba(NO3)2溶液、AgNO3溶液)

回答下列问题:
(1)①试剂1是________结论1是________;
②试剂2是________结论2是________;
③试剂3是________结论3是________ 。
(2)写出有关反应的离子方程式
①__________________;
②__________________;
③__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+、Cu2+、Ba2+、Al3+、和五种阴离子Cl-、OH-、NO3-、CO32-、X中的一种。
(1)某同学通过比较分析,认为无须检验就可判断其中必有的两种物质是_______和____________。
(2)物质C中含有离子X。为了确定X,现将(1)中的两种物质记为A和B,当 C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体,则X为__________(填序号)。
a.Br- b. SO42- c.CH3COO- d. HCO3-
(3)将19.2gCu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,写出Cu溶解的离子方程式_____________________________,若要将Cu完全溶解,至少加入H2SO4的物质的量是___________________________。
(4)E溶液与氢碘酸反应时可生成棕色物质,该反应的离子方程式为:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列加横线的字所指代物质的主要成分与其他三项不同的是( )
A.儿童散学归来早,忙趁东风放纸鸢B.黑发不知勤学早,白首方悔读书迟
C.散入珠帘湿罗幕,狐裘不暖锦衾薄D.绚丽丝绸云涌动,霓裳歌舞美仙姿
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态不饱和链烃CnHm在一定条件下与H2加成为CnHm+x,取CnHm和H2混合气体共60mL进行实验,发现随混合气中H2所占体积的变化,反应后得到的气体总体积数也不同,反应前混合气体中H2所占的体积V(H2)和反应后气体总体积V(反应后总)的关系如图所示(气体体积均在同温同压下测定).由此可知x的数值为
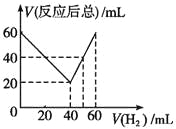
A. 4 B. 3 C. 2 D. 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质用途与物质性质的对应关系中,不正确的是
选项 | 性质 | 用途 |
A | 氧化铁呈红棕色 | 红色涂料 |
B | 金属的焰色反应 | 制烟花 |
C | 浓硫酸具有脱水性 | 干燥剂 |
D | 液氨汽化时要吸收大量的热 | 制冷剂 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列物质的电离方程式:
NH4NO3______________________;
HClO___________________;
NaHCO3______________________。
(2)写出下列反应的离子方程式:
硫酸铜溶液与氢氧化钠溶液混合____________________________________________。
碳酸钠溶液与稀盐酸混合___________________________________________________。
氯化钾溶液与硝酸银溶液混合_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com