
【题目】已知KMnO4与浓盐酸反应的化学方程式为:2KMnO4+16HCl(浓)=2MnCl2+8H2O+2KCl+5Cl2↑,回答下列问题:
(1)该反应的离子方程式为________________________________________________。
(2)被氧化的HCl占HCl总量的__________________________。
(3)当标准状况下有11.2L氯气生成时,该反应转移的电子数为________________(设NA为阿伏加德罗常数的值)。
(4)15.8 g KMnO4与100 mL 12 mol/L浓盐酸完全反应(假设HCl无挥发),在反应后的溶液中加入足量的AgNO3溶液,可生成____________________g沉淀。(要求写出计算过程)
【答案】 2MnO4-+16H+10Cl-=2Mn2++8H2O+5Cl2↑ ![]() NA 100.45
NA 100.45
【解析】(1)根据反应的化学方程式可知该反应的离子方程式为2MnO4-+16H+10Cl-=2Mn2++8H2O+5Cl2↑;(2)根据方程式可知16mol氯化氢参加反应生成5mol氯气,即被氧化的HCl是10mol,占HCl总量的10/16=5/8;(3)标准状况下11.2L氯气的物质的量是11.2L÷22.4L/mol=0.5mol,反应中氯元素化合价从-1价升高到0价,失去1个电子,因此该反应转移的电子的物质的量是0.5mol×2=1mol,电子数为NA;(4)15.8 g KMnO4的物质的量是15.8g÷158g/mol=0.1mol,完全反应消耗氯化氢是0.8mol。100 mL 12 mol/L浓盐酸的物质的量是0.1L×12mol/L=1.2mol,因此浓盐酸过量,生成氯气是0.25mol,根据氯原子守恒可知反应后溶液中氯离子的物质的量是1.2mol-0.25mol×2=0.7mol,在反应后的溶液中加入足量的AgNO3溶液,可生成0.7mol氯化银沉淀,质量是0.7mol×143.5g/mol=100.45g。


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.放热反应在任何温度下均能自发进行
B.自发过程指的是常温下,不借助外力就能自动进行的过程
C.熵增加的放热反应在任何温度下均能自发进行
D.对于同一物质,其混乱度大小为S(g)<S(l)<S(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:

查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡,Sn相对原子质量为119。
回答下列问题:
(1) 操作Ⅰ是________________、过滤洗涤。
(2)SnCl2粉末需加浓盐酸进行溶解的原因_______________________。
(3)加入Sn粉的作用有两个:①调节溶液pH,②_______________。
(4)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是______________。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是________________。
(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl![]() SnCl2+ H2↑;
SnCl2+ H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:6FeCl2+ K2Cr2O7+ 14HCl![]() 6FeCl3+ 2KCl + 2CrCl3+7H2O
6FeCl3+ 2KCl + 2CrCl3+7H2O
现取0.80 g锡粉,经上述各步反应后,共用去0.1000 mol/L K2Cr2O7溶液20.00mL。则锡粉中锡的纯度为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有0.2 mol NaOH和0.1 mol Ba(OH)2的溶液中持续稳定地通入CO2气体,当通入气体为8.96 L(0 ℃,1.01×105Pa)时立即停止,则这一过程中,溶液中离子的物质的量与通入CO2气体的体积关系图像正确的是(气体的溶解和离子的水解忽略不计)( )。
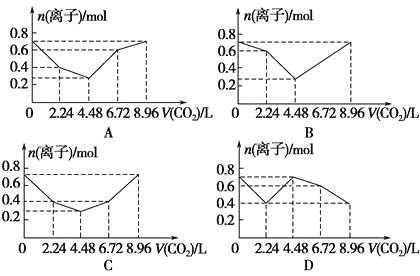
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)白磷与氧气可发生如下反应:P4+5O2===P4O10。已知断裂下列化学键需要吸收的能量分别为P—P a kJ·mol-1、P—O b kJ·mol-1、P===O c kJ·mol-1、O===O d kJ·mol-1。

根据图示的分子结构和有关数据估算该反应的ΔH为 。
(2)同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
①P4(白磷,s)+5O2(g)===P4O10(s) ΔH1=-2 983.2 kJ·mol-1
②P(红磷,s)+![]() O2(g)===
O2(g)===![]() P4O10(s) ΔH2=-738.5 kJ·mol-1
P4O10(s) ΔH2=-738.5 kJ·mol-1
相同状况下,能量较低的是 ;白磷的稳定性比红磷 (填“大”或“小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟甲香豆素是一种治疗胆结石的药物,合成路线如下图所示:

已知:
RCOOR'+R'OH![]() RCOOR'+ R'OH(R、R'、R'代表烃基)
RCOOR'+ R'OH(R、R'、R'代表烃基)
(1)A属于芳香烃,其结构简式是______________________。B中所含的官能团是________________。
(2)C→D的反应类型是___________________。
(3)E属于脂类。仅以乙醇为有机原料,选用必要的无机试剂合成E,写出有关化学方程式:______________________________。
(4)已知:2E![]() F+C2H5OH。F所含官能团有
F+C2H5OH。F所含官能团有![]() 和___________。
和___________。
(5)以D和F为原料合成羟甲香豆素分为三步反应,写出有关化合物的结构简式:

____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯是调制草莓、葡萄屑桃,香子兰等香味的食用香精。在医药工业中作为有机合成的中问体。合成肉桂酸甲酯的工业流程如图所示:

已知:I.醛与醛能发生反应,原理如下:

Ⅱ.烃A在标准状况下的密度为1.25g/L。
请回答:
(1)化合物E的名称为_____________
(2)合成肉挂酸甲酯的工业流程中属于取代反应的有_______个,C中所含的官能团有 _______(写名称)。
(3)G→H的反应化学方程式为_____________。
(4)符合下列条件的的同分异构体共有_____________种。
A.能发生水解反应
B.与银氨溶液作用出现光亮的银镜
C.能与溴生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”.如2Fe3++Cu=2Fe2++Cu2+,可拆写为氧化反应式:Cu→Cu2++2e-,还原反应式:2Fe3++2e-→2Fe2+.在稀硫酸中,KMnO4和H2O2能发生氧化还原反应5H2O2+2MnO+6H+===5O2↑+2Mn2++8H2O。
(1)将此氧化还原反应拆成半反应式,氧化式:_________,还原式:_________。
(2)反应中氧化剂是________;被氧化元素是__________;若有0.5 mol H2O2参加此反应,电子转移个数为____________。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为________________________;这时若有0.5 mol H2O2发生分解,电子转移个数为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com