
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A. 标准状况下,22.4LH2与254gI2充分反应,形成2NA个H-I键
B. 通入1molCl2的新制氯水中,HClO、Cl-、ClO-粒子数之和为2NA
C. 64gCu与足量的硫粉加热,充分反应转移的电子数为NA
D. 等体积、等物质的量浓度的NaCl和KF溶液中,阴、阳离子数目之和相等
【答案】C
【解析】
A.在标准状况下,22.4LH2与254gI2,各为1mol,由于H2![]() I2
I2![]() 2HI是可逆反应,所以形成H-I键小于2NA个,故A错误;
2HI是可逆反应,所以形成H-I键小于2NA个,故A错误;
B.通入1molCl2的新制氯水中,存在氯气的溶解平衡,所以溶液中还有Cl2,HClO、Cl-、ClO-粒子数之和小于2NA,故B错误;
C.Cu与足量的硫粉加热生成Cu2S,所以64gCu与足量的硫粉加热,充分反应转移的电子数为NA,故C正确;
D.在体积的情况下,欲分析阴、阳离子数目之和是否相等,只需比较离子浓度之和就可以了,NaCl溶液中,含有的离子是:Na+、Cl-、H+、OH-,依据电荷守恒有c(Na+)![]() c(H+)=c(Cl-)
c(H+)=c(Cl-)![]() c(OH-),阴阳离子的浓度之和为:c(Na+)
c(OH-),阴阳离子的浓度之和为:c(Na+)![]() c(H+)
c(H+)![]() c(Cl-)
c(Cl-)![]() c(OH-)=2(c(Na+)
c(OH-)=2(c(Na+)![]() c(H+)),同理可知:在KF溶液中,阴阳离子浓度之和为2(c(K+)
c(H+)),同理可知:在KF溶液中,阴阳离子浓度之和为2(c(K+)![]() c(H+)),因KF是强碱弱酸盐,水解显碱性,所以KF溶液中的c(H+))小于NaCl溶液中的c(H+)),而两溶液中c(Na+)=c(K+),所以等体积、等物质的量浓度的NaCl和KF溶液中,阴、阳离子数目之和不相等,故D错误;
c(H+)),因KF是强碱弱酸盐,水解显碱性,所以KF溶液中的c(H+))小于NaCl溶液中的c(H+)),而两溶液中c(Na+)=c(K+),所以等体积、等物质的量浓度的NaCl和KF溶液中,阴、阳离子数目之和不相等,故D错误;
本题答案为C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)常温下,2L pH=12的Ba(OH)2溶液的物质的量浓度为________,从中取出10mL加水稀释到100mL,pH=______。
(2)已知500mLAl2(SO4)3溶液中含有Al3+为0.5mol,则Al2(SO4)3溶液的物质的量浓度为____mol/L,取上述溶液50mL加水到150mL,此溶液中SO42-的物质的量浓度为_____mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将一定量的气体通入体积为2 L的密闭容器中,使其发生反应,有关物质X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( )

A. 该反应的化学方程式为:3Z![]() 2X+3Y
2X+3Y
B. t0时,反应停止,反应速率为0
C. t0时,Z的浓度为1.2 mol/L
D. t0时,X、Y、Z的质量不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O)简称“三盐”,白色或微黄色粉末,热稳定性能优良,主要用作聚氯乙烯的热稳定剂。“三盐”是由可溶性铅盐中加入硫酸生成硫酸铅,再加氢氧化钠而制得。以100.0吨铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示

已知:(1)Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13;
(2)铅与冷盐酸、冷硫酸几乎不起作用。
请回答下列问题:
(1)写出步骤①“转化”的化学方程式_________________________________
(2)步骤②“过滤1”后所得滤渣的主要成分为_____________
(3)步骤③“酸溶”,最适合选用的酸为___________,为提高酸溶速率,可采取的措施是____________________________________(任意写出一条)
(4)若步骤④“沉铅”后的滤液中c(Pb2+)=1.82×10-5mol·L-1,则此时c(SO42-)=_________ mol·L-1
(5)从原子利用率的角度分析该流程的优点为____________________________________。
(6)步骤⑥“合成”三盐的化学方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77kJ·mol-1
CH3OH(g) △H3=-90.77kJ·mol-1
回答下列问题:
(1)反应Ⅱ的△H2=______________。
(2)反应Ⅲ能够自发进行的条件是__________ (填“较低温度”、“ 较高温度”或“任何温度”)
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是________。
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1
D.甲醇的百分含量不再变化
(4)对于反应Ⅰ,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是__________。

A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
B.温度低于250℃时,随温度升高甲醇的产率增大
C.M点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(5)若在1L密闭容器中充入3molH2和1molCO2发生反应Ⅰ,250℃时反应的平衡常数K=______;若要进一步提高甲醇体积分数。可采取的措施有_________________。
(6)下图是电解Na2CO3溶液的装置图。

阴极的电极反应式为________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象能推出相应结论的是
选项 | 实验操作和现象 | 结论 |
A | 向NaAlO2溶液中滴加NaHCO3 溶液,产生白色沉淀 | AlO2-与HCO3-发生了相互促进的水解反应 |
B | 向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀 | X不一定具有氧化性 |
C | 灼热的木炭加入浓硝酸中,放出红棕色气体 | 一定是木炭与浓硝酸反应生成了NO2 |
D | 将乙醇与浓硫酸共热,制得的气体直接通入酸性KMnO4溶液中,酸性KMnO4溶液褪色 | 说明制得的气体中含有乙烯 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含有C.H、O的有机物3.24 g,装入元素分析装置,通入足量的O2使它完全燃烧,将生成的气体依次通过氯化钙干燥管A和碱石灰干燥管B。测得A管质量增加了2.16g,B管增加了9.24g。已知该有机物的相对分子质量为108。
(1)燃烧此化合物3.24g,须消耗氧气的质量是多少______?
(2)求此化合物的分子式______?(要有简单计算过程)
(3)该化合物1分子中存在1个苯环和1个羟基,试写出它的同分异构体的结构简式______。(计算要有文字说明过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F(C11H12O2)属于芳香酯类物质,可由下列路线合成:
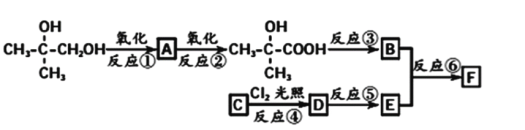
已知:B在一定条件下可发生加聚反应形成高分子化合物
回答下列问题:
(1)A中官能团的名称是____________,上述③④⑤⑥反应中属于取代反应的有_____(填相应序号)
(2)反应③的条件是___________________。
(3)写出B发生加聚反应形成高分子化合物的化学方程式____________________。
(4)反应⑥的化学方程式是__________________________________
(5)A、B、E三种有机物,可用下列的某一种试剂鉴别,该试剂是______.
a.新制的Cu(OH)2悬浊液 b.溴水 c.酸性KMnO4溶液 d.溴的CCl4溶液
(6)G是E的同系物且相对分子质量比E大28.G有多种同分异构体,其中符合下列条件的同分异构体有_____种①能与Na2CO3溶液反应 ②分子中含有两个-CH3.其中核磁共振氢谱有5组峰,且面积比为6:1:2:2:1的结构简式____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中甲为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,乙为电解饱和MgCl2溶液的装置,其中乙装置中X为阳离子交换膜。用该装置进行实验,反应开始后观察到Fe电极附近出现白色沉淀。下列说法正确的是
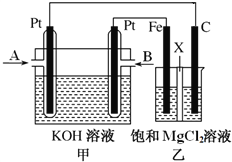
A. 甲中A处通入CH4,电极反应式为CH4+10OH--8e-=== ![]() +7H2O
+7H2O
B. 乙中电解MgCl2溶液的总反应为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C. 理论上甲中每消耗22.4 L CH4(标准状况下),乙中产生4 mol Cl2
D. 甲、乙中电解质溶液的pH都增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com