
【题目】某小组在实验室探究Ba(OH)2溶液与稀盐酸反应的实质。向0.2mol/L Ba(OH)2溶液中滴加0.1mol/L盐酸,测定导电率的变化如图所示,回答下列问题:

(1)Ba(OH)2在水中以离子形式存在的实验证据是___________。Ba(OH)2的电离方程式为___________。
(2)A-B段,发生的离子反应是__________。
(3)B点恰好完全反应,此时溶液中存在的微粒有H2O、__________。
(4)下列化学反应的实质与Ba(OH)2溶液与稀盐酸反应的实质相同的是__________。
A. Ba(OH)2和H2SO4 B. NaOH和H2SO4 C. Ba(OH)2与HNO3
【答案】A点的导电率高 Ba(OH)2 = Ba2+ + 2OH- H+ + OH-= H2O Ba2+、Cl- BC
【解析】
溶液的导电率和离子浓度有关系,和离子所带电荷也有关系。 A→B段,H+和OH-反应生成H2O,溶液中离子浓度减小;B→C段,随着盐酸的加入,溶液中离子浓度增大,溶液导电率增高;因此可以推出B点时,Ba(OH)2和HCl恰好完全反应。
(1)A→B段,A点的溶液导电率高,随着盐酸的量的增多,溶液的导电率减小,是因为发生反应H++OH-=H2O,溶液中离子浓度减小,说明Ba(OH)2在水中以离子形式存在;Ba(OH)2的电离方程式为:Ba(OH)2 =Ba2++2OH-;
(2)A-B段,Ba(OH)2和HCl发生反应,离子方程式为:H+ +OH-=H2O;
(3)B点,Ba(OH)2和HCl恰好完全反应,此时溶液中存在的微粒有H2O、Ba2+、Cl-;
(4)Ba(OH)2溶液与稀盐酸反应的实质是:H+ +OH-=H2O;
A、Ba(OH)2和H2SO4反应的实质是:2H+ +SO42-+Ba2++2OH-=BaSO4↓+2H2O;
B、NaOH和H2SO4反应的实质是:H+ +OH-=H2O;
C、Ba(OH)2与HNO3反应的实质是:H+ +OH-=H2O;
则B、C符合题意,故选BC。


科目:高中化学 来源: 题型:
【题目】食盐是日常生活的必需品,也是重要的化工原料。粗食盐中常含有少量K+、Ca2+、Mg2+、Fe3+、SO42—等杂质离子,实验室提纯NaCl的流程如下:
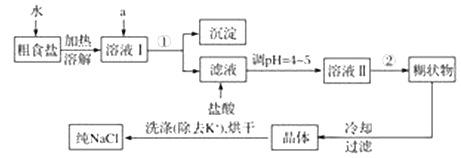
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇。
(1)在过滤过程中所需要的玻璃仪器有________________________________________。
(2)欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42—,选出a所代表的试剂,按滴加顺序依次为_______(只填化学式)。
(3)用于沉淀的试剂需过量,否则不能将杂质除尽,检验过滤的滤液中是否含有Fe3+的方法__________,过滤所得沉淀需要洗涤,洗涤沉淀的方法__________________。
(4)用提纯的NaCl配制成480ml 0.2molL-1的NaCl溶液,用托盘天平称取___________ g纯的NaCl晶体,用蒸馏水在_______________中溶解,完全溶解后,全部转移至________________中,加蒸馏水至______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲![]() 乙
乙![]() 丙。下列有关物质的推断不正确的是( )
丙。下列有关物质的推断不正确的是( )
A.若甲为NaOH溶液,则丁可能是CO2B.若乙为Al(OH)3,则丁可能是NaOH
C.若甲为Fe,则丁可能是Cl2D.若丁是O2,则甲可能为C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是喷泉实验装置图,下列说法不正确的是
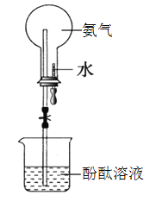
A.烧瓶中的溶液呈红色
B.该实验说明氨气可电离产生OH-
C.该实验说明氨气易溶于水
D.形成喷泉的原因是烧瓶内压强小于外界大气压
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
已知:①CuCl可以由CuCl2用适当的还原剂如SO2,SnCl2等还原制得:2Cu2++2Cl-+SO2+2H2O![]() 2CuCl↓+4H++SO42-,2CuCl2+SnCl2=2CuCl↓+SnCl4,②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子:
2CuCl↓+4H++SO42-,2CuCl2+SnCl2=2CuCl↓+SnCl4,②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子:  。
。
请回答下列问题:
(1)基态Cu原子的核外电子排布式为_____;H、N、O三种元素的电负性由大到小的顺序是____。
(2)SO2分子的空间构型为________;与SnCl4互为等电子体的一种离子的化学式为________。
(3)乙二胺分子中氮原子轨道的杂化类型为________。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是__________。
(4)②中所形成的配离子中含有的化学键类型有______(填字母)。
A.配位键 B.极性键 C.离子键 D.非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物吗替麦考酚酯有强大的抑制淋巴细胞增殖的作用,可通过如下反应制得:
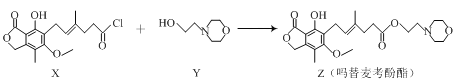 +HCl
+HCl
下列叙述正确的是
A.用溴水可鉴别化合物X和ZB.化合物Y的分子式为C6H12NO2
C.化合物Z中含有手性碳原子D.1mol化合物Z可以与3molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
I.2015年国产C919大型客机正式下线,标志着我国成为世界上少数几个具有自行研制大型飞机的国家之一,标志着我国航空工业进入了新的发展阶段。
(1)飞机的外壳通常采用镁-铝合金材料,铝的价电子排布图为 ,第一电离能:镁 (填“大于”或“小于”)铝。
(2)现代飞机为了减轻质量而不减轻外壳承压能力,通常采用复合材料--玻璃纤维增强塑料,其成分之一为环氧树脂,常见的E51型环氧树脂中部分结构如下图所示:
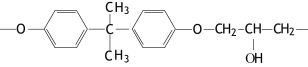

其中碳原子的杂化方式为 ,个数比为 。
II.大型飞机的发动机被誉为航空工业皇冠上的“宝石”。制造过程中通常采用碳化钨做关键部位的材料。
(3)钨元素位于周期表的第六周期第VIB族,请写出其外围电子排布式 ;
(4)下图为碳化钨晶体的一部分结构, 碳原子嵌入金属钨的晶格的间隙,并不破坏原有金属的晶格,形成填隙+固溶体,也称为填隙化合物。在此结构中,其中钨原子有 个,1个钨原子周围距离钨原子最近的碳原子有 个 ,下列金属元素的堆积方式与碳化钨晶胞中碳原子和钨原子所处位置类似的是 。
A. Fe Cu B.Ti Au C.Mg Zn D.Cu Ag
(5)假设该部分晶体的体积为Vcm3,碳化钨的摩尔质量为M g/mol,密度为b g/cm3,则阿伏加德罗常数NA用上述数据可以表示为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图a酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是由碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH,下列说法不正确的是

有关数据如下表所示:
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
A.该电池的正极反应式为MnO2+eˉ+H+=MnOOH
B.利用干电池,高温电解H2O–CO2混合气体制备H2和CO,如图b,则阴、阳两极生成的气体的物质的量之比是1:1
C.废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵,两者可以通过重结晶方法分离
D.废电池糊状填充物加水处理后所得滤渣的主要成分是二氧化锰、碳粉和MnOOH,欲从中得到较纯的二氧化锰,可以采用加热的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍是原子能、火箭、导弹、航空、宇宙航行以及冶金工业中不可缺少的一种新兴材料。以某地的含氟铍矿(主要成分为BeO、CaF2、Al2O3、Fe2O3、SiO2及少量的硫酸盐)为原料,生产工业氧化铍的一种工艺流程如图:
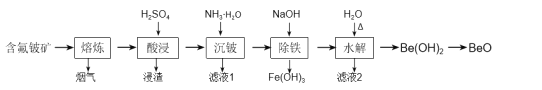
已知:①25℃,Ksp(CaCO3)=8.7×10-9;Ksp(CaSO4)=2.5×10-5;
②Be(OH)2与Al(OH)3性质相似。
回答下列问题:
(1)“熔炼”的温度为1600℃,其中约20%的Al2O3反应生成烟气(主要成分为AlF3),该反应的化学方程式为___。
(2)浸渣的主要成分为CaSO4、___。
(3)加入氨水中和酸浸液,若将pH调至8~9,“沉铍”时产生的沉淀物主要有:___、___、___。
(4)“沉铍”后将滤渣加入足量氢氧化钠溶液提高pH进行“除铁”,铍元素参与反应的离子方程式为___,然后加适量水稀释进行“水解”,目的是___。
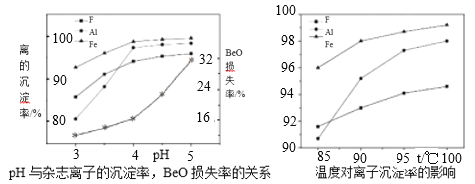
(5)若为高氟铍矿,需在“沉铍”前进行“除氟”。工业上“除氟”是加入10%的氨水,并控制一定的条件,使氟与铝铁形成共沉淀物而除去。根据如图实验数据,选择的实验条件为pH=___,水浴加热温度T=___℃。
(6)氧化铍粗产品含有一定量的硫酸盐会影响铍的后续冶炼,可用碳酸盐脱除,发生反应:CaSO4(s)+Na2CO3(aq)=CaCO3(s)+Na2SO4(aq)。通过计算反应的K值说明用碳酸钠脱硫酸根反应的程度大小:__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com