
【题目】如图a酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是由碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH,下列说法不正确的是

有关数据如下表所示:
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
A.该电池的正极反应式为MnO2+eˉ+H+=MnOOH
B.利用干电池,高温电解H2O–CO2混合气体制备H2和CO,如图b,则阴、阳两极生成的气体的物质的量之比是1:1
C.废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵,两者可以通过重结晶方法分离
D.废电池糊状填充物加水处理后所得滤渣的主要成分是二氧化锰、碳粉和MnOOH,欲从中得到较纯的二氧化锰,可以采用加热的方法
【答案】B
【解析】
A.该电池在放电过程产生MnOOH,根据原电池原理,正极上MnO2得电子生成MnOOH,则该电池的正极反应式为MnO2+e-+H+=MnOOH,A项正确;
B.根据电解池原理,阳极上发生氧化反应,生成氧气,阴极上发生还原反应,生成H2和CO,电解池总反应方程式为:H2O+CO2![]() H2+CO+O2,则阴、阳两极生成的气体的物质的量之比是2:1,B项错误;
H2+CO+O2,则阴、阳两极生成的气体的物质的量之比是2:1,B项错误;
C.由表中数据可知,氯化锌的溶解度受温度的影响更大,能通过重结晶方法分离氯化锌和氯化铵,C项正确;
D.在空气中加热碳粉会转化为二氧化碳,MnOOH分解生成二氧化锰,所以加热法可以除去二氧化锰中的MnOOH和碳粉,得到较纯的二氧化锰,D项正确;
答案选B。


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】有Al、CuO、Fe2O3组成的混合物共10.0 g,放入500 mL某浓度的盐酸溶液中,混合物完全溶解,当再加入250 mL 2.0 mol/L的NaOH溶液时,得到的沉淀最多。上述盐酸溶液的浓度为( )
A. 1mol/L B. 2 mol/L C. 0.5 mol/L D. 1.5 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组在实验室探究Ba(OH)2溶液与稀盐酸反应的实质。向0.2mol/L Ba(OH)2溶液中滴加0.1mol/L盐酸,测定导电率的变化如图所示,回答下列问题:

(1)Ba(OH)2在水中以离子形式存在的实验证据是___________。Ba(OH)2的电离方程式为___________。
(2)A-B段,发生的离子反应是__________。
(3)B点恰好完全反应,此时溶液中存在的微粒有H2O、__________。
(4)下列化学反应的实质与Ba(OH)2溶液与稀盐酸反应的实质相同的是__________。
A. Ba(OH)2和H2SO4 B. NaOH和H2SO4 C. Ba(OH)2与HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】灼热的焦炭与水蒸气反应所得产物为H2、CO和少量CO2,为了检验产物中的H2和CO(设气体均被充分吸收),设计如下实验装置。下列有关说法错误的是
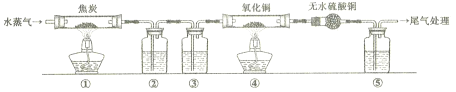
A. 为了实验安全,应先点燃①处酒精灯,后点燃④处酒精灯
B. ②、③、⑤中依次盛装氢氧化钠溶液、浓硫酸和澄清石灰水
C. ④中黑色固体变红色,即可证明产物中一定含有H2和CO中的一种或两种
D. 若用碱石灰替换无水硫酸铜,也可以达到检验H2和CO目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关钠的化合物说法正确的是( )
A. 将NaOH浓溶液滴加到饱和FeCl3溶液中制备Fe(OH)3胶体
B. 用加热法除去NaHCO3固体中混有的Na2CO3
C. 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,一定没有K+
D. Na2O2可用于呼吸面具中氧气的来源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧元素为地壳中含量最高的元素,可形成多种重要的单质和化合物。
(1)氧元素位于元素周期表中___________区;第二周期元素中,第一电离能比氧大的有___________种。
(2)O3可用于消毒。O3的中心原子的杂化形式为___________;其分子的 VSEPR模型为___________,与其互为等电子体的离子为___________(写出一种即可)。
(3)含氧有机物中,氧原子的成键方式不同会导致有机物性质不同。解释C2H5OH的沸点高于CH3OCH3的原因为___________;C2H5OH不能用无水CaCl2千燥是因为Ca2+和C2H5OH可形成[Ca(C2H5OH)4]2+,该离子的结构式可表示为______________________。
(4)氧元素可分别与Fe和Cu形成低价态氧化物FeO和Cu2O。

①FeO立方晶胞结构如图1所示,则Fe2+的配位数为___________;与O2-紧邻的所有Fe2+构成的几何构型为___________。
②Cu2O立方晶胞结构如图2所示,若O2-与Cu+之间最近距离为a pm,则该晶体的密度为___________g·cm-3。(用含a、NA的代数式表示,NA代表阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅酸蓄电池价格低廉,原材料易得,适用范围广。其放电时的反应原理为:
Pb+PbO2+2H2SO4===2PbSO4+2H2O。

(1) 写出铅酸蓄电池放电时正极的电极反应式:________,放电时,H+向电池______极定向移动(填“正”或“负”)。
(2) 传统的铅酸蓄电池在充电末期,电极上会产生O2,为了避免气体逸出形成酸雾腐蚀设备,科学家发明了密封铅蓄电池(VRLA),采用阴极吸收法达到密封效果。其原理如图所示,则O2在阴极被吸收的电极反应式为________。
(3) 铅的电解精炼是工业上实现废铅回收以及粗铅提纯的重要手段。铅的电解精炼在由PbSiF6和H2SiF6两种强电解质组成的水溶液中进行。从还原炉中产出的某粗铅成分如下表所示:
成分 | Pb | Cu | Ag | Fe | Zn | Sn | 其它 |
% | 97.50 | 1.22 | 0.12 | 0.15 | 0.09 | 0.64 | 0.28 |
①电解精炼时阳极泥的主要成分是________(元素符号)。
②电解后阴极得到的铅中仍含有微量的杂质,该杂质最有可能是________(填一种)。
③电解过程中,粗铅表面会生成SiF6气体,写出该电极反应式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA 表示阿伏加德罗常数,下列叙述正确的是( )
A.常温常压下,4gH2含有的分子数为2NA
B.17g氨气所含电子数目为8NA
C.将1体积c1mol/L的硫酸溶于4体积水中 ,稀溶液的浓度为0.2c1mol/L
D.将5.85gNaCl 晶体溶入100mL水中,制得0.1mol/L的NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述中正确的是( )
A. 分子总数为NA的二氧化硫和二氧化碳混合气体中含有的原子数为3NA
B. 任何条件下,20 L 氧气含有的分子数都不可能为NA
C. 在标准状况下,2 g氖气含有NA个氖原子
D. 物质的量相等的任何气体中都含有相同的原子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com