
【题目】反应4A(s)+3B(g)=2C(g)+D(g),经2min后B的浓度减少0.6mol/L。对此反应速率的正确表示是( )
A.用B、C、D分别表示反应的速率,其比值是3:2:1
B.用A表示的反应速率是0.4mol/(L·min)
C.在2min末的反应速率用B表示是0.3mol/(L·min)
D.在这2min内用B和C表示的速率的值都是逐渐增大的
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】在恒温条件下,向盛有食盐的2L恒容密闭容器中加入0.2molNO2、0.2molNO和0.1molCl2,发生如下两个反应:
①2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) △H1<0平衡常数K1
NaNO3(s)+ClNO(g) △H1<0平衡常数K1
②2NO(g)+Cl2(g)![]() 2ClNO(g) △H2<0 平衡常数K2
2ClNO(g) △H2<0 平衡常数K2
10分钟时反应达到平衡,测得容器内体系的压强减少20%,10分钟内用ClNO(g)表示的平均反应速率v(ClNO)=7.5×10-3mol/(Lmin)。下列说法不正确的是( )
A.反应4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) 的平衡常数为
2NaNO3(s)+2NO(g)+Cl2(g) 的平衡常数为![]()
B.平衡后c(Cl2)=2.5×10-2mol/L
C.其它条件保持不变,反应在恒压条件下进行,则平衡常数K2增大
D.平衡时NO2的转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于小苏打水溶液的表述正确的是
A. c (Na+)=c (HCO3-) + c (CO32-) + 2c (H2CO3)
B. c (Na+) + c (H+) = c (HCO3-) + 2c (CO32-) +c (OH-)
C. HCO3- 的电离程度大于HCO3-的水解程度
D. 存在的电离有:NaHCO3=Na++HCO3—,HCO3— ![]() H++CO32—,
H++CO32—,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的分子式为C11H20,1 mol 该烃在催化剂作用下可以吸收2 mol H2;用热的KMnO4酸性溶液氧化,得到下列三种有机物:
![]() HOOC—CH2CH2—COOH。
HOOC—CH2CH2—COOH。
已知:
![]()
 +R3-COOH(R1-、R2-、R3-代表烃基)
+R3-COOH(R1-、R2-、R3-代表烃基)
由此推断写出该烃可能的结构简式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知AgCl为难溶于水和酸的白色固体,Ag2S为难溶于水和酸的黑色固体。向AgCl 和水的悬浊液中加入足量的Na2S溶液并振荡,结果白色固体完全转化为黑色固体:
(1)写出白色固体转化成黑色固体的化学方程式:__________________________
(2)白色固体转化成黑色固体的原因是:____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mlbmol·L-1的CH3COOH溶液中滴加等体积的0.01mol·L-1的NaOH溶液,充分反应后溶液中c(CH3COO-)=c(Na+),下列说法不正确的是
A. b>0.01
B. 混合后溶液呈中性
C. CH3COOH的电离常数Ka=![]()
D. 向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华法林是一种治疗心脑血管疾病的药物,可由化合物![]() 和
和![]() 在一定条件下合成得到(部分反应条件略)。
在一定条件下合成得到(部分反应条件略)。

请回答下列问题:
(1)![]() 的名称为______,
的名称为______,![]() 的反应类型为______。
的反应类型为______。
(2)![]() 的分子式是______。
的分子式是______。![]() 的反应中,加入的化合物
的反应中,加入的化合物![]() 与银氨溶液可发生银镜反应,该银镜反应的化学方程式为____________________________________。
与银氨溶液可发生银镜反应,该银镜反应的化学方程式为____________________________________。
(3)![]() 为取代反应,其另一产物分子中的官能团名称是____________。
为取代反应,其另一产物分子中的官能团名称是____________。![]() 完全燃烧最少需要消耗 ____________
完全燃烧最少需要消耗 ____________![]() 。
。
(4)![]() 的同分异构体
的同分异构体![]() 是芳香酸,
是芳香酸, ,
,![]() 的核磁共振氢谱只有两组峰,
的核磁共振氢谱只有两组峰,![]() 的结构简式为____________,
的结构简式为____________,![]() 的化学方程式为________________________。
的化学方程式为________________________。
(5)上图中,能缩合成体型高分子化合物的酚类单体是____________ ,写出能检验该物质存在的显色反应中所用的试剂及实验现象__________________________________________。
(6)已知:![]() 的原理为:①C6H5OH+
的原理为:①C6H5OH+ +C2H5OH和②
+C2H5OH和②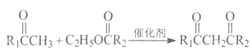 +C2H5OH,
+C2H5OH,![]() 的结构简式为____________。
的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和K2SO4溶液。下列说法正确的是( )

A. b电极上发生还原反应
B. 外电路电流方向是从a到b
C. 电池工作时,盐桥中的SO42-移向甲烧杯
D. a电极上发生的反应为MnO4-+8H++5e-=Mn2++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:

(1)气体A中的大气污染物可选用下列试剂中的_______吸收.
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在__________(填离子符号),检验溶液中还存在Fe2+的方法是_____________________________(注明试剂、现象).
(3)由泡铜冶炼粗铜的化学反应方程式为________________________.
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是_________.
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(5)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为______________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com