
【题目】下列物质中,在一定条件下既能发生银镜反应,又能发生水解反应的是( )
A. 葡萄糖 B. 淀粉 C. 甲酸甲酯 D. 油脂
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有资料认为NO、NO2不能与Na2O2反应。某小组学生提出质疑,从理论上分析Na2O2和NO2都有氧化性,根据化合价升降原则提出假设并进行探究:
假设Ⅰ.Na2O2能氧化NO2
假设Ⅱ.NO2能氧化Na2O2
(1)小组甲同学设计了如图实验装置,并进行如下实验:
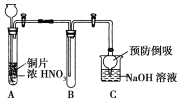
①试管A中发生反应的化学方程式是______________________________。
②待试管B中收集满气体,向试管B中加入适量Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带余烬的木条迅速伸进试管内,看见木条复燃。甲同学认为假设Ⅱ正确;乙同学认为该装置不能达到实验目的,为达到实验目的,在A、B之间增加一个装置,该装置的作用是______________________________。
③乙同学用改进后装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;但带余烬的木条未复燃。得出结论:假设Ⅰ正确。NO2和Na2O2反应的化学方程式是
_____________________________________________________________________。
(2)丙同学认为NO易被O2氧化,更易被Na2O2氧化。
查阅资料:①2NO+Na2O2===2NaNO2
②6NaNO2+3H2SO4===3Na2SO4+2HNO3+4NO↑+2H2O
③酸性条件下,NO或NO都能与MnO反应生成NO和Mn2+
丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。
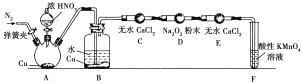
①A装置中盛装Cu片的仪器名称是__________,B中观察到的主要现象是______________________,F装置的作用是______________________________。
②在反应前,打开弹簧夹,通入一段时间N2,目的是______________________________。
③充分反应后,检验D装置中产物是NaNO2还是NaNO3的实验方法是____________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达平衡,平衡常数K=![]() 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
A、该反应的焓变为正值
B、恒温恒容下,增大压强,H2浓度一定减小
C、升高温度,逆反应速率减小
D、该反应化学方程式为CO+H2O=CO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度、压强下,1体积X2气体和3体积Y2气体化合生成2体积的气体化合物,则该气体化合物的化学式为 ( )
A. XY3 B. XY C. X3Y D. X2Y3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异戊二烯是重要的有机化工原料,其结构简式为CH2=C(CH3)CH=CH2。
完成下列填空:
(1)化合物X与异戊二烯具有相同的分子式,与Br2/CCl4反应后得到3-甲基-1,1,2,2-四溴丁烷。X的结构简式为_______________。
(2)异戊二烯的一种制备方法如下图所示:
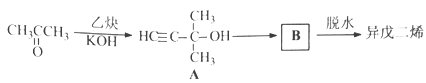
A能发生的反应有___________。(填反应类型)
B的结构简式为______________。
(3)设计一条由异戊二烯制得有机合成中间体 的合成路线。
的合成路线。
(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是重要的化工原料,也是应用广泛的化工产品。CO2与过氧化钠或超氧化钾反应可产生氧气。
完成下列计算:
(1)CO2通入氨水生成NH4HCO3,NH4HCO3很容易分解。2.00mol NH4HCO3完全分解,分解产物经干燥后的体积为_________L(标准状况)。
(2)某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为_______。
(3)CO2和KO2有下列反应:
4KO2+2CO2→2K2CO3+3O2
4KO2+4CO2+2H2O→4KHCO3+3O2
若9 mol CO2在密封舱内和KO2反应后生成9 molO2,则反应前密封舱内H2O的量应该是多少?列式计算。
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O![]() CO+3H2
CO+3H2
已知:CO+2H2![]() CH3OH CO2+3H2
CH3OH CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资源的高效利用对保护环境、促进经济持续健康发展具有重要作用。磷尾矿主要含Ca5(PO4)3F和CaCO3·MgCO3。某研究小组提出了磷尾矿综合利用的研究方案,制备具有重要工业用途的CaCO3、Mg(OH)2、P4和H2,其简化流程如下:

已知:①Ca5(PO4)3F在950℃不分解;
②4Ca5(PO4)3F+18SiO2+30C![]() 2CaF2+30CO+18CaSiO3+3P4
2CaF2+30CO+18CaSiO3+3P4
请回答下列问题:
(1)950℃煅烧磷尾矿生成气体的主要成分是___________。
(2)实验室过滤所需的玻璃仪器是_____________。
(3)NH4NO3溶液能从磷矿Ⅰ中浸取出Ca2+的原因是__________。
(4)在浸取液Ⅱ中通入NH3,发生反应的化学方程式是____________。
(5)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) ΔH=-271kJ/mol
5 CaO(s)+3H3PO4(l)+HF(g)= Ca5(PO4)3F (s)+5H2O(l) ΔH=-937kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是_________________。
(6)在一定条件下CO(g)+H2O(g)![]() CO2(g)+H2(g),当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化了
CO2(g)+H2(g),当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化了![]() 。若a kg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1:3混合,则相同条件下达平衡时能产生H2________kg。
。若a kg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1:3混合,则相同条件下达平衡时能产生H2________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兰尼镍是一种带有多孔结构的细小晶粒组成的镍铝合金,被广泛用作有机物的氢化反应的催化剂。以红土镍矿(主要成分为NiS、FeS和SiO2等)为原料制备兰尼镍的工艺流程如下图所示:

(1)在形成Ni(CO)4的过程中,碳元素的化合价没有变化,则Ni(CO)4中的Ni的化合价为___________;
(2)已知红土镍矿煅烧后生成Ni2O3,而加压酸浸后浸出液A中含有Ni2+,写出有关镍元素的加压酸浸的化学反应方程式______________________;
(3)向浸出液A中通入H2S气体,反应的离子方程式是____________________;
(4)“高温熔融”时能否将通入氩气换为CO并说明原因_____________________;
(5)“碱浸”的目的是使镍铝合金产生多孔结构,从而增强对氢气的强吸附性,此过程
中发生反应的离子方程式为___________________。浸出反应所用的NaOH溶液的浓度要大,若NaOH溶液较稀时,则会产生少量的Al(OH)3沉淀而阻止浸出反应的持续进行,请用化学反应原理加以解释:________________________。
(6)浸出液B可以回收,重新生成铝以便循环利用。请设计简单的回收流程:
浸出液B→________________________。(示例:CuOCu2+Cu)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com