
����Ŀ����ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״���CH3OH������������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�ء���֪H2(g)��CO(g)��CH3OH(l)��ȼ���ȡ�H�ֱ�Ϊ��285.8kJ��mol��1����283.0kJ��mol��1�ͣ�726.5kJ��mol��1
��ش��������⣺
��1����̫���ֽܷ�10molˮ���ĵ�������______kJ��
��2���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪ ��
��3�����ݻ�Ϊ2L���ܱ������У���CO2��H2�ϳɼ״���Ӧ����ʽΪ��CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g)���������������������£������¶ȶԷ�Ӧ��Ӱ�죬ʵ��������ͼ��ʾ������˵����ȷ����__________������ţ�
CH3OH(g) + H2O(g)���������������������£������¶ȶԷ�Ӧ��Ӱ�죬ʵ��������ͼ��ʾ������˵����ȷ����__________������ţ�

��250��ʱ��0��10minH2��Ӧ����Ϊ0.015mol/(L��min)
�ڸ÷�Ӧ��Tʱ���ɼ״������ʱ�250��ʱ��С
��Tʱ����3v(CO)=v(H2)����÷�Ӧ�ﵽƽ��
�����ܱ������л�������ܶȲ�����÷�Ӧ�ﵽ��ѧƽ��״̬
��ƽ��ʱCO2��ת���ʣ�T��ʱ����250��ʱ
��4����T�¶�ʱ����1molCO2��3molH2����һ�ܱպ��������У���ַ�Ӧ�ﵽƽ�����CO2ת����Ϊa���������ڵ�ѹǿ����ʼѹǿ֮��Ϊ ��
��5����ֱ���Լ״�Ϊȼ�ϵĵ���У��������ҺΪ���ԣ������ķ�ӦʽΪ ��
���𰸡���1��2858��1�֣���2��CH3OH(l)+O2(g)=CO(g)+2H2O(l) ��H=��443.5kJ��mol��1��2�֣�
��3��������2�֣���4��1��(a/2)��2�֣���5��CH3OH��6e��+8OH��=CO32��+6H2O��2�֣�
��������
�����������1����H2��g����ȼ���ȡ�HΪ-285.8kJ��mol-1֪��1mol H2��g����ȫȼ������1mol H2O��1���ų�����285.8kJ�����ֽ�1mol H2O��1��Ϊ1mol H2��g�����ĵ�����Ϊ285.8kJ���ֽ�10mol H2O��1�����ĵ�����Ϊ2858kJ��
��2����������д��ȼ���ȵ��Ȼ�ѧ����ʽΪCO(g)+1/2O2(g)=CO2(g)��H=-283.0kJ��mol-1 ��
CH3OH��1��+3/2O2(g)=CO2(g)+2 H2O��1�� ��H=-726.5kJ��mol-1 ��
�â�-�ٵã�CH3OH(l)+O2(g)=CO(g)+2H2O(l) ��H=��443.5kJ��mol��1��
��3���ٸ������ͼ�������֪��250��ʱ��0��10min�״�������0.15mol����Ӧ��������0.45mol�� H2��Ӧ����Ϊ0.45mol��(2L��10min)=0.0225mol/(L��min)�����ڸ��ݡ��ȹ���ƽ���¸�ѹ��250�����T�棬�¶�Խ�ߣ���ѧ��Ӧ����Խ�죬��÷�Ӧ��Tʱ���ɼ״������ʱ�250��ʱ��С����ȷ����Tʱ����3v(CO)=v(H2)��û��ָ�����淴Ӧ����˵���÷�Ӧ�ﵽƽ�⣬���ܸ÷�Ӧ�����ܱպ��ݵ������н��У����������ܶ�ʼ�ձ��ֲ��䣬���ܶȲ��䲻��˵���÷�Ӧ�ﵽ��ѧƽ��״̬�����ݸ������������250�����T�棬�¶����ߣ��״������������ͣ�˵��ƽ�������ƶ�����ƽ��ʱCO2��ת���ʣ�T��ʱ����250��ʱ����ȷ����ѡ������
��4�����û�ѧƽ�������ģʽ�����㣺
CO2(g) + 3H2(g) = CH3OH(g) + H2O(g)
��ʼ 1 3 0 0
�仯 a 3a a a
ƽ�� 1-a 3-3a a a
����ѹǿ֮�ȵ������ʵ���֮�ȣ��������ڵ�ѹǿ����ʼѹǿ֮��Ϊ��(4-2a)/4=1-a/2
��5��ȼ�ϵ����ԭ�����һ�֣�����ʧ���ӣ�����������Ӧ�������õ��ӣ�������ԭ��Ӧ���ڼ��������У��״�ȼ�ϵ�صĸ�����ӦʽΪCH3OH��6e��+8OH��=CO32��+6H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݱ��е���Ϣ�ж�����˵����ȷ����
���� | ���ʯ | ʯī |
��� | ��ɫ�������� | �Һڣ��������� |
�۵� | �� | �� |
ȼ����/kJ��mol��1 | 395.4 | 393.5 |
A����ʾʯīȼ���ȵ��Ȼ�ѧ����ʽΪC(ʯī��s)+1/2O2(g)=CO(g) ��H=��393.5 kJ��mol��1
B���ɱ�����Ϣ֪C(ʯī����s)=C(���ʯ��s) ��H=+1.9 kJ��mol��1
C���ɱ�����Ϣ�ɵ���ͼ��ʾ��ͼ��

D���ɱ�����Ϣ����֪��ͬ�����½��ʯ���۵����ʯī���۵�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���X��C��H��O����Ԫ�أ�����֪������������̼��������������������������������������(������ɱ�״���µ����)����X������������ܶȣ���X����������X�ķе㡣ȷ��X�ķ���ʽ����Ҫ������������
A. �٢ڢ� B. �٢ڢ� C. �٢ۢ� D. �٢ڢۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������������ȷ������ ��
A��100 mL 0.1 mol��L��1 Na2SO4��Һ�У���������0.03 NA
B����״���£�������ΪNA��N2��C2H4��������������ȷ��
C�����³�ѹ�£�32 g O2�����������ӵ���ĿΪ17 NA
D����״���£�11.2 L�ƾ����еķ�����Ϊ0.5 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ���������У�A��B��C��D��Ϊʯī�缫�����������й���0.02mol����ͨ����������������ȷ���ǣ� ��
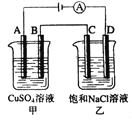
A. ���ձ���A������������ͭ0.64g
B. ���ձ���B���ϵ缫��Ӧʽ4OH����4e���� 2H2O+O2��
C. ���ձ��е����̪��Һ��D�������ȱ��
D. �ձ���C���ϵ缫��ӦʽΪ4H+ + 4e����2H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼Ԫ���ǹ���ϸ���������Ԫ�أ��Դ�����˵�����Ľ�����
A. ̼��ϸ���ĸ��ֻ������к������
B. ̼����Ȼ���к�����Ϊ�ḻ
C. ��ϸ���ĸ��ֻ������ж�����̼
D. ̼���������л���Ļ����Ǽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣����������10��Ԫ�أ�������и�С�⣮
| ��A | ��A | ��A | ��A | ��A | ��A | ����A | 0 |
2 | C | N | O | |||||
3 | Na | Mg | Si | S | Cl | Ar | ||
4 | Ca |
��1����ѧ��������õ�Ԫ���� ����Ԫ�����ƣ���
��2��Nԭ�ӽṹʾ��ͼΪ ��Ca������������Ϊ ��
��3����
��4��C��N��Oԭ�Ӱ뾶��С�����˳����� ��
��5����2��������̬�⻯�����ȶ����� �����ѧʽ����
��6��Si�Ǵ���������������ҪԪ��֮һ����������Ҫ��;�� ��д��һ�֣���
��7�������Ǵ���Ȼ��������ı�����п�����ȡ�ĵ�һ���������� �����ʵ���ɫ��ӦΪ ɫ������¶�ڿ������׳�������Ϊ������ ��
��8��Na��Al����������ˮ����֮�䷴Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ������ ��
A��NaHSO4��Һ��Ba(OH)2��Һ��Ӧ�����ԣ�H++SO42��+Ba2++OH��=BaSO4��+H2O
B���������廯������������������Ӧ��2Fe2����4Br����3Cl2=2Fe3����2Br2��6Cl��
C����������������ʴ��������Ӧʽ��O2+4e��+2H2O=4OH��
D���������缫��ⱥ��ʳ��ˮ��2Cl��+2H2O![]() Cl2��+H2��+2OH��
Cl2��+H2��+2OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��2H2(g)+O2(g)=2H2O(l) ��H=-571.6 kJ��mol-l��
C3H8 (g)+5O2( g)=3CO2(g)+4H2O(1) ��H =-2220 kJ��mol-l.
����H2��C3H8�Ļ�����干5 mol����ȫȼ��ʱ����3847 kJ�����ڻ��������H2��C3H8��������ǣ� ��
A��2��1 B��3��1 C��4��1 D��5��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com