
A、乙醇与乙酸在浓硫酸存在时加热的反应: +CH3CH2OH +CH3CH2OH
 +H2O +H2O | |||
| B、碱性甲烷燃料电池的负极反应式为:CH4+10OH--8e-=CO32-+7H2O | |||
C、蔗糖在稀硫酸作催化剂时的水解反应:C12H22O11(蔗糖)+H2O
| |||
D、苯的硝化反应: +HNO3(浓) +HNO3(浓)
 |
| 催化剂 |
| 浓硫酸 |
| 50℃-60℃ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、3:2 | B、2:3 |
| C、2:1 | D、l:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等 |
| B、最外层电子数为8的粒子是稀有气体元素的原子 |
| C、在周期表里,主族元素所在的族序数等于原子核外电子数 |
| D、周期表中L层电子为奇数的元素所在族序数与该元素原子的L层电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3、Al(OH)3、NaOH |
| B、Na2CO3、NaAlO2、Al2O3 |
| C、NaHCO3、NaAlO2、NaOH |
| D、Na2CO3、NaHCO3、Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有①正确 |
| B、只有②正确 |
| C、只有③正确 |
| D、全部都正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
 将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置:
将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置:查看答案和解析>>
科目:高中化学 来源: 题型:
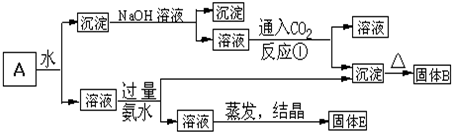
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com