
| 电离能/kJ?mol-1 | |||||||
| X | 578 | 1817 | 2745 | 11575 | 14830 | 18376 | 23293 |
| Y | 738 | 1451 | 7733 | 10540 | 13630 | 17995 | 21703 |
| Z | 496 | 4562 | 6912 | 9943 | 13353 | 16610 | 20114 |
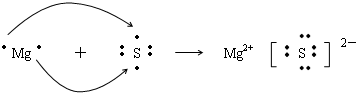

 ,
, ;
;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其他 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | Z | M | R | Q | 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | 其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 电离能/kJ?mol-1 | |||||||
| X | 578 | 1817 | 2745 | 11575 | 14830 | 18376 | 23293 |
| Y | 738 | 1451 | 7733 | 10540 | 13630 | 17995 | 21703 |
| Z | 496 | 4562 | 6912 | 9943 | 13353 | 16610 | 20114 |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省南通市通州区平潮高级中学高一(下)月考化学试卷(一)(解析版) 题型:解答题
| 电离能/kJ?mol-1 | |||||||
| X | 578 | 1817 | 2745 | 11575 | 14830 | 18376 | 23293 |
| Y | 738 | 1451 | 7733 | 10540 | 13630 | 17995 | 21703 |
| Z | 496 | 4562 | 6912 | 9943 | 13353 | 16610 | 20114 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com