
【题目】白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成 P4O6,空气充足时生成 P4O10。
(1)已知 298K 时白磷、红磷完全燃烧的热化学方程式分别为
![]() △H1 =—2983.2kJ/mol
△H1 =—2983.2kJ/mol
![]() △H2 =—738.5kJ/mol
△H2 =—738.5kJ/mol
则该温度下白磷转化为红磷的热化学方程式为________________________.
(2)已知 298K 时白磷不完全燃烧的热化学方程式为 ![]() △H =—1638kJ/mol。在某密闭容器中加入 62g 白磷和50.4L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O6 与P4O10 的物质的量之比为________________,反应过程中放出的热为_________________
△H =—1638kJ/mol。在某密闭容器中加入 62g 白磷和50.4L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O6 与P4O10 的物质的量之比为________________,反应过程中放出的热为_________________
(3)已知白磷和 PCl3 的分子结构如图所示,现提供以下化学键的键能(KJ/mol):P-P:198, Cl-Cl:243, P-Cl :331 .
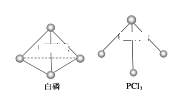
则反应 ![]() 的反应热 △H2 =__________.
的反应热 △H2 =__________.
【答案】![]() △H=—29.2kJ/mol 3:1 1323.45kJ -1326KJ/mol
△H=—29.2kJ/mol 3:1 1323.45kJ -1326KJ/mol
【解析】
(1)![]() △H1 =—2983.2kJ/mol ,①
△H1 =—2983.2kJ/mol ,①
![]() △H2 =—738.5kJ/mol ,②
△H2 =—738.5kJ/mol ,②
根据盖斯定律:①-②×4可得:![]() ,
,![]() ,
,![]() ,
,
则![]() △H=—29.2kJ/mol;
△H=—29.2kJ/mol;
(2)62g白磷中磷原子物质的量:![]() ,氧气物质的量:
,氧气物质的量:![]() ,含有4.5mol氧原子,
,含有4.5mol氧原子,
设P4O10物质的量为x,P4O6物质的量为y,
磷原子守恒,得![]() ,
,
氧原子守恒,得![]() ,
,
计算出,x=0.375mol,y=0.125mol,故物质的量之比为3:1;
![]() ,
,
放出的热量:![]() ,得
,得![]() 。
。
(3)![]() 的反应热,根据:反应热=反应物的键能和-生成物的键能和,
的反应热,根据:反应热=反应物的键能和-生成物的键能和,![]() ,
,![]() 。
。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
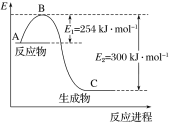
(1)上图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:______________。
(2)若已知下列数据:
化学键 | H—H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N—H的键能:________ kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=-a kJ·mol-1①
N2(g)+O2(g)===2NO(g) ΔH2=-b kJ·mol-1②
若1 mol NH3还原NO至N2,则该反应过程中的反应热ΔH3=________ kJ·mol-1(用含a、b的式子表示)。
(4)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g) ![]() (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g) ![]() NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
则ΔH3与ΔH1、ΔH2之间的关系是ΔH3=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活息息相关。现有下列4种有机物:①乙炔 ②乙二醇 ③甲苯 ④苯酚,请将相应的序号填入空格内。
(1)用做汽车防冻剂的是___;
(2)可用于杀菌消毒、制造阿司匹林等,俗称石炭酸的是___;
(3)常用来焊接或切割金属的是___。
(4)制造烈性炸药TNT的化学方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是短周期元素,其部分性质如下表:
W | 单质是淡黄色固体 |
X | 在地壳中的含量居第二位 |
Y | 原子最外层电子数是电子总数的 |
Z | 第三周期原子半径最小的金属元素 |
下列说法正确的是
A. 气态氢化物的热稳定性:X>W B. Z的氧化物中含有非极性共价键
C. 离子半径:Z>W D. 最高价氧化物对应水化物的酸性:Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(CaSO4)= 9×10-4,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断中正确的是

A. a点对应的溶液中c(H+)·c(OH-) 的数值为1×10-14
B. a 点对应的Ksp不等于c点对应的Ksp
C. b 点将有沉淀生成,平衡后溶液中c(SO42-)= 3×10-3mol/L,而向d 点溶液中加入适量的CaSO4固体可以变到c 点
D. CaSO4的饱和溶液中c(SO42-) > c(Ca2+) >c(H+) >c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表,下列说法错误的是
物质 | X Y Z |
初始浓度/mol·L-1 | 0.1 0.2 0 |
平衡浓度/mol·L-1 | 0.05 0.05 0.1 |
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y![]() 2Z
2Z
C.平衡常数 K = 1600 mol-2·L2
D.增大压强和升高温度,平衡正方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与电化学和金属的防护密切相关。请回答下列问题:
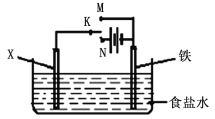
(1)将反应2Ag++Cu = 2Ag+Cu2+ 反应设计成如图所示的原电池.

则Ag 发生的反应是_______反应(填“氧化”、“还原”),X极的电极反应式为_______,该电池放电时,盐桥中的NO3-离子将移向_________溶液。如果将盐桥换成Cu条,则甲池为__________池(装置),X的电极名称是_________。
(2)铅蓄电池是当今生活中应用比较广泛的一种可充电电池,总反应式为:Pb+PbO2+2H2SO4 ![]() 2PbSO4 +2H2O。放电时,负极反应式为_______________;充电时,铅蓄电池的正极应与直流电源的________极相连,该电极的电极反应式为_____。
2PbSO4 +2H2O。放电时,负极反应式为_______________;充电时,铅蓄电池的正极应与直流电源的________极相连,该电极的电极反应式为_____。
(3)金属的防护方法有多种。如图是模拟铁的电化学防护。若X为碳棒,为减缓腐蚀,开关K应置于________处;反应的总反应离子方程式为______________,若X为锌,开关K置于M处,该电化学防护法称为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A. In是第五周期第ⅢA族元素
B. 11549In的中子数与电子数的差值为17
C. 原子半径:In>Al
D. 碱性:In(OH)3>RbOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com