
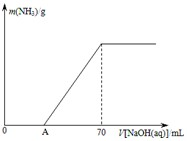
 某氮肥NH4HCO3中混有少量(NH4)2CO3,现采用下列方案测定该氮肥中(NH4)2CO3的质量分数:称取5.7g上述样品与2.0mol/L NaOH溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用NaOH溶液体积的关系如图所示:
某氮肥NH4HCO3中混有少量(NH4)2CO3,现采用下列方案测定该氮肥中(NH4)2CO3的质量分数:称取5.7g上述样品与2.0mol/L NaOH溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用NaOH溶液体积的关系如图所示: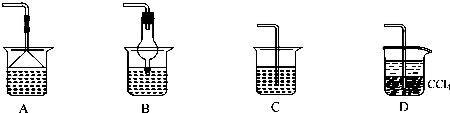
| 5.7g×X |
| 96g/mol |
| 5.7g(1-X) |
| 79g/mol |
| 5.7g×(1-16.9%) |
| 79g/mol |


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| 催化剂 |
| 高温高压 |
| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)某氮肥NH4HCO3中混有少量(NH4)2CO3,现采用下列方案测定该氮肥中(NH4)2CO3的质量分数:称取5.7 g上述样品与2.0 mol/L NaOH溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用NaOH溶液体积的关系如图所示:
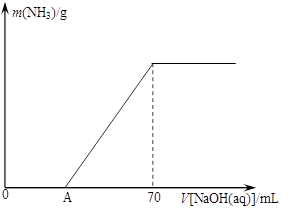
请回答下列问题:
⑴A点前样品与NaOH反应的离子方程式为 ▲ 。
⑵为使生成的氨气被硫酸吸收时不发生倒吸,可以选用下列装置中的 ▲ 。
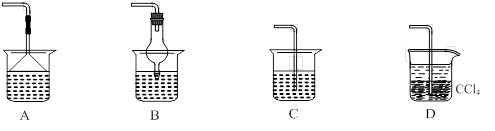
⑶样品中(NH4)2CO3的质量分数是 ▲ %(保留一位小数)。
⑷当V[NaOH(aq)]=50 mL时,生成NH3的质量为 ▲ 。
查看答案和解析>>
科目:高中化学 来源:2012届江苏省南通市高三上学期期末调研测试化学试卷 题型:填空题
(12分)某氮肥NH4HCO3中混有少量(NH4)2CO3,现采用下列方案测定该氮肥中(NH4)2CO3的质量分数:称取5.7 g上述样品与2.0 mol/L NaOH溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用NaOH溶液体积的关系如图所示: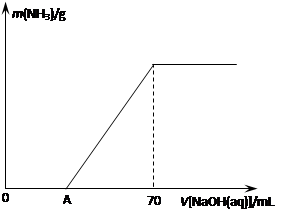
请回答下列问题:
⑴A点前样品与NaOH反应的离子方程式为 ▲ 。
⑵为使生成的氨气被硫酸吸收时不发生倒吸,可以选用下列装置中的 ▲ 。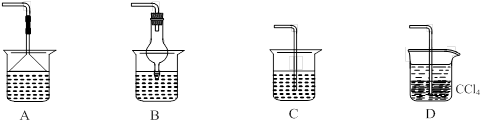
⑶样品中(NH4)2CO3的质量分数是 ▲ %(保留一位小数)。
⑷当V[NaOH(aq)]="50" mL时,生成NH3的质量为 ▲ 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省南通市高三上学期期末调研测试化学试卷 题型:填空题
(12分)某氮肥NH4HCO3中混有少量(NH4)2CO3,现采用下列方案测定该氮肥中(NH4)2CO3的质量分数:称取5.7 g上述样品与2.0 mol/L NaOH溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用NaOH溶液体积的关系如图所示:
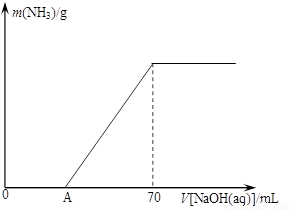
请回答下列问题:
⑴A点前样品与NaOH反应的离子方程式为 ▲ 。
⑵为使生成的氨气被硫酸吸收时不发生倒吸,可以选用下列装置中的 ▲ 。
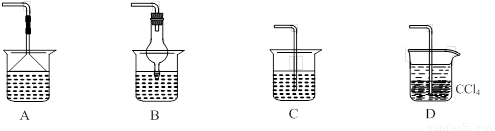
⑶样品中(NH4)2CO3的质量分数是 ▲ %(保留一位小数)。
⑷当V[NaOH(aq)]=50 mL时,生成NH3的质量为 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com