
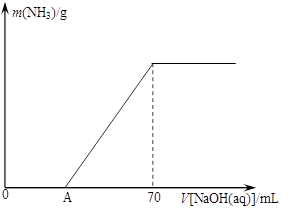
��12�֣�ij����NH4HCO3�л�������(NH4)2CO3���ֲ������з����ⶨ�õ�����(NH4)2CO3��������������ȡ5.7 g������Ʒ��2.0 mol/L NaOH��Һ��ϣ���ȫ�ܽ���¼���ʹ���ַ�Ӧ�����¶�����β��ֽ⣩����ʹ���ɵİ���ȫ�����������գ���ð���������������NaOH��Һ����Ĺ�ϵ��ͼ��ʾ��
��ش��������⣺
��A��ǰ��Ʒ��NaOH��Ӧ�����ӷ���ʽΪ �� ��
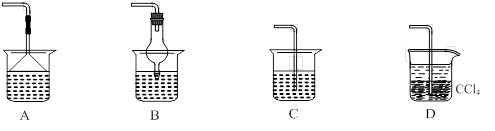
��Ϊʹ���ɵİ�������������ʱ����������������ѡ������װ���е� �� ��
����Ʒ��(NH4)2CO3������������ �� %������һλС������
�ȵ�V[NaOH(aq)]=50 mLʱ������NH3������Ϊ �� ��
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ||
| ||
| ���� |
| ���¸�ѹ |
| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ij����NH4HCO3�л���������NH4��2CO3���ֲ������з����ⶨ�õ����У�NH4��2CO3��������������ȡ5.7g������Ʒ��2.0mol/L NaOH��Һ��ϣ���ȫ�ܽ���¼���ʹ���ַ�Ӧ�����¶�����β��ֽ⣩����ʹ���ɵİ���ȫ�����������գ���ð���������������NaOH��Һ����Ĺ�ϵ��ͼ��ʾ��
ij����NH4HCO3�л���������NH4��2CO3���ֲ������з����ⶨ�õ����У�NH4��2CO3��������������ȡ5.7g������Ʒ��2.0mol/L NaOH��Һ��ϣ���ȫ�ܽ���¼���ʹ���ַ�Ӧ�����¶�����β��ֽ⣩����ʹ���ɵİ���ȫ�����������գ���ð���������������NaOH��Һ����Ĺ�ϵ��ͼ��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012�콭��ʡ��ͨ�и�����ѧ����ĩ���в��Ի�ѧ�Ծ� ���ͣ������
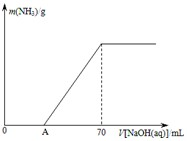
��12�֣�ij����NH4HCO3�л�������(NH4)2CO3���ֲ������з����ⶨ�õ�����(NH4)2CO3��������������ȡ5.7 g������Ʒ��2.0 mol/L NaOH��Һ��ϣ���ȫ�ܽ���¼���ʹ���ַ�Ӧ�����¶�����β��ֽ⣩����ʹ���ɵİ���ȫ�����������գ���ð���������������NaOH��Һ����Ĺ�ϵ��ͼ��ʾ��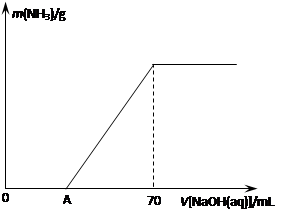
��ش��������⣺
��A��ǰ��Ʒ��NaOH��Ӧ�����ӷ���ʽΪ �� ��
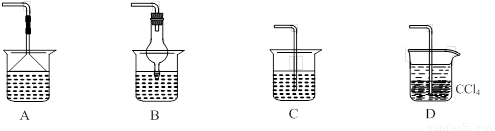
��Ϊʹ���ɵİ�������������ʱ����������������ѡ������װ���е� �� ��
����Ʒ��(NH4)2CO3������������ �� %������һλС������
�ȵ�V[NaOH(aq)]="50" mLʱ������NH3������Ϊ �� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�꽭��ʡ��ͨ�и�����ѧ����ĩ���в��Ի�ѧ�Ծ� ���ͣ������
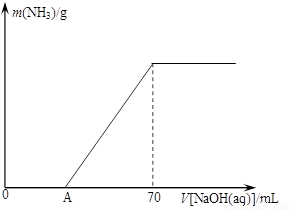
��12�֣�ij����NH4HCO3�л�������(NH4)2CO3���ֲ������з����ⶨ�õ�����(NH4)2CO3��������������ȡ5.7 g������Ʒ��2.0 mol/L NaOH��Һ��ϣ���ȫ�ܽ���¼���ʹ���ַ�Ӧ�����¶�����β��ֽ⣩����ʹ���ɵİ���ȫ�����������գ���ð���������������NaOH��Һ����Ĺ�ϵ��ͼ��ʾ��
��ش��������⣺
��A��ǰ��Ʒ��NaOH��Ӧ�����ӷ���ʽΪ �� ��
��Ϊʹ���ɵİ�������������ʱ����������������ѡ������װ���е� �� ��
����Ʒ��(NH4)2CO3������������ �� %������һλС������
�ȵ�V[NaOH(aq)]=50 mLʱ������NH3������Ϊ �� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com