
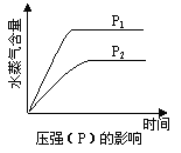
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是
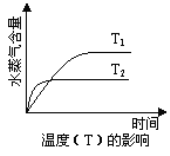
A. CO2(g) + 2NH3(g)![]() CO(NH2)2(s) + H2O(g); △H<0 ,△S<0
CO(NH2)2(s) + H2O(g); △H<0 ,△S<0
B. CO2(g) + H2(g)![]() CO(g) + H2O(g); △H>0,△S=0
CO(g) + H2O(g); △H>0,△S=0
C. CH3CH2OH (g)![]() CH2=CH2(g) + H2O(g); △H>0,△S>0
CH2=CH2(g) + H2O(g); △H>0,△S>0
D. 2C6H5CH2CH3(g) + O2(g)![]() 2 C6H5CH=CH2(g) + 2H2O(g); △H<0,△S>0
2 C6H5CH=CH2(g) + 2H2O(g); △H<0,△S>0
【答案】A
【解析】
根据图像“先拐先平数值大”可知:T2> T2,P1> P2,降低温度和增大压强水蒸气含量增大,即平衡向正向移动,所以正反应为放热反应,也是气体分子数减小的反应,以此分析。
A项,由热化学方程式可知,反应正向进行,放出热量,当温度升高时,反应速率加快,但是平衡逆向移动,水蒸气含量降低,同时,该反应正向进行时,体积减小,如果增大压强,反应正向进行,浓度提高,反应速率加快,故A项正确;
B项,正反应吸收热量,温度升高,平衡正向移动,水蒸气含量升高,故B项错误;
C项,该反应正向进行时,吸收热量,如果升高温度,平衡正向移动,会生成更多的水,故C项错误;
D项,正反应向着体积增大的方向进行,如果增大压强,平衡逆向移动,水蒸气含量降低,故D项错误。
综上所述,本题正确答案为A。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】海水中有丰富的化学资源,从海水中可提取多种化工原料。
以下为工业从海水中提取液溴的流程图如下,已知:溴的沸点为59 ℃,微溶于水,有毒性。

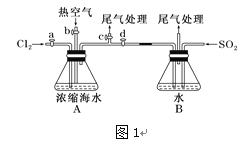
(1)某同学利用“图1”装置进行实验,当进行步骤①时,应关闭活塞___,打开活塞______。
(2)步骤③中反应的离子方程式____________________________。
(3)从“溴水混合物Ⅰ”到“溴水混合物Ⅱ”的目的是________________________。
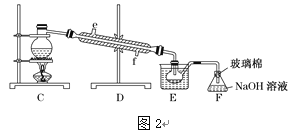
(4)步骤⑤用“图2”装置进行蒸馏,C处蒸馏烧瓶中已加入碎瓷片,尚未安装温度计,此外装置C中还有一处,改进后效果会更好,应该如何改进_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:I2(g)+H2(g)2HI(g),在密闭容器中进行,下列条件能加快化学反应速率的是( )
A.缩小体积使压强增大B.体积不变充入He使气体压强增大
C.体积不变使压强减小D.使总压强不变,充入Ne
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应mX(g)+nY(g)![]() qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
A. X的正反应速率是Y的逆反应速率的m/n倍
B. 通入稀有气体使压强增大,平衡将正向移动
C. 降低温度,混合气体的平均相对分子质量变小
D. 增加X的物质的量,Y的转化率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g) + O2(g)![]() 2SO3(g) + 190 kJ
2SO3(g) + 190 kJ
(1)该反应的平衡常数表达式K =___________,该反应450℃时的平衡常数_________500℃时的平衡常数(填“>”“<”或“=”)。
(2)在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3 0.18 mol,则v(O2) =____________mol/(L·min)
(3)请写出提高SO2转化率的两种方法__________________、___________________。
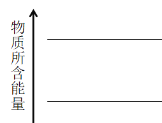
(4)根据反应方程式,请在图中,绘制反应方向箭头,并在合适位置标明物质与热量 ___________。
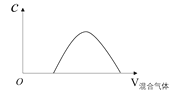
(5)将SO2与SO3的混合气体持续通入一定量的NaOH溶液中,产物中某离子的物质的量浓度与通入气体的体积有如图所示关系,该离子是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A | B | C | D |
|
|
|
|
升高温度, | 0~3s内,反应速率为: | t1时仅加入催化剂, | 达平衡时,仅改变x,则x为c(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵在500℃时隔绝空气加热完全分解,回答下列问题:
(1)硫酸亚铁铵隔绝空气加热完全分解发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和_________。
(2)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。
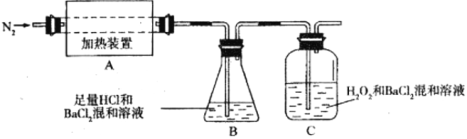
①为验证A中残留物是否含有FeO,需要选用的试剂有_________。
A.KSCN溶液 B.稀硫酸 C.浓盐酸 D.KMnO4溶液
②装置B中BaCl2溶液的作用是为了检验分解产物中是否有_________气体生成,若含有该气体,观察到的现象为___________________。
③若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为bmol,C中沉淀物质的量为amol,则b_________a(填“大于”、“小于”或“等于”)
④实验中,观察到C中有白色沉淀生成,则C中发生反应的离子方程式为________________。
(3)为测定某固体样品中(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的含量,某实验小组做了如下实验:MnO4-+Fe2++H+=Mn2++Fe3++H2O(方程式未配平)
测定步骤:
步骤一:准确称量20.00g硫酸亚铁铵晶体,配制成100mL溶液。
步骤二:取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,用0.1000mol·L-1KMnO4溶液滴定至终点,重复两次,平均消耗KMnO4溶液16.00mL。
①步骤二达到滴定终点的标志为________________________;
②产品中(NH4)2Fe(SO4)2·6H2O的质量分数为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子一定能大量共存的是( )
A.H+、Fe2+、SO42-、NO3-B.Fe3+、NH4+、Cl-、SCN-
C.NH4+、Al3+、OH-、SO42-D.Na+、K+、NO3-、CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com